
����Ŀ��ijѧ������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ��������д���пհף�
��1���ñ�������ζ������NaOH��Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע��________��ֱ�������һ���������Һ�ɻ�ɫ��Ϊ��ɫ����___________Ϊֹ��
��2�����в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵���________(�����)��
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
��3�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ������ͼ��ʾ������������Һ�����Ϊ________mL��
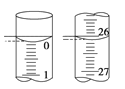
��4��ijѧ������3��ʵ��ֱ��¼�й��������±���
�ζ����� | ����NaOH��Һ�����/mL | 0.100 0 mol��L��1��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 26.11 | 26.11 |
�ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
������ | 25.00 | 0.22 | 26.31 | 26.09 |
�����ϱ�������ʽ�����NaOH��Һ�����ʵ���Ũ��________________��
���𰸡���1����ƿ����Һ��ɫ�仯���ڰ�����ڲ���ɫ��
��2��D����3��26.10����4��0.104 4 mol��L��1
��������
�����������1�� �ñ�������ζ������NaOH��Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�仯��ֱ�������һ���������Һ�ɻ�ɫ��Ϊ��ɫ�����ڰ�����ڲ���ɫΪֹ�ʹﵽ�ζ��յ㣬ֹͣ�μ������Һ����2�� A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע������ᣬ�������ı�����Һ�����ƫ��ʹ�ⶨ���ƫ�ߣ�����B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и�����ڲ�Ӱ�����Һ�����ʵ���Ũ�ȣ����ԶԵζ�����������κ�Ӱ�죬����C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ��ʹ������Һ�����ƫ���²ⶨ���ƫ�ߣ�����D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ�����ʹ���ĵı�����Һ�����ƫС�����²ⶨ���ƫ�ͣ���ȷ����3������ͼʾ��֪���ڵζ���ʼʱ��Һ�Ķ�����0.00mL���ζ��յ�ʱ��Һ�Ķ�����26.10mL����������������Һ�����Ϊ26.10mL-0.00mL=26.10mL����4���������ݷ�����֪�ڶ���ʵ�����̫��Ҫ��ȥ����Ӧ���ĵı�����Һ��ƽ�������V��![]() ��26.10 mL�������ᡢ�Ӧʱ���ʵ�����ȿ�֪c(NaOH) ��
��26.10 mL�������ᡢ�Ӧʱ���ʵ�����ȿ�֪c(NaOH) �� ![]() �� 0.104 4 mol��L��1��
�� 0.104 4 mol��L��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ת����ϵ�У�������һ����Ӧֱ��ʵ�ֵ��ǣ� ��
A. ��Ȳ��������ϩB. �ױ����������ױ�
C. �Ҵ���������D. ��ϩ���Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����Ϊ��������������þ����Ͻ���;�ܹ㣬Ŀǰ������60%��þ�Ӻ�ˮ����ȡ���Ӻ�ˮ����ȡþ���������£�
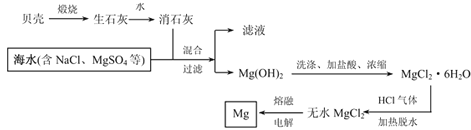
�������������ͼ��þ������������ʻش��������⣺
��1���ñ���������ʯ�ҵķ�Ӧ����ʽ��________________
��2��������þ������������ӷ���ʽΪ��_____________��
��3����������MgCl2��6H2O����ˮMgCl2������ʱͨHCl�������Ҫԭ����:___________��
��4������þ���ڣ���д���б�ţ�:___________��
a.��ɫ���� b����ɫ���� c������� d.�ؽ��� e�������
��5��Mg(OH)2���տɵ��۵�ܸߵ�MgO��MgO�ĵ���ʽΪ��____________��
��6��MgCl2��AlCl3���۵���ϵͣ���MgO��Al2O3���۵㶼�ܸߡ�Ϊʲôұ������þ�ǵ��MgCl2����ұ������������Al2O3��_______________��
��7��ijMgCl2��Һ��Ũ��Ϊ0.01mol/L���ڸ���Һ�еμ�NaOH��Һ��pH=10����ʱ��Һ�е�Mg2+�Ƿ������ȫ��_________������������������������ʱc(Mg2+)=_________��
����֪��Ksp[Mg(OH)2]=1.8��10-11��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����OH��������ͬ�������͵�������������(����)
A. H2O B. F��
C. Na�� D. NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ��Ϊ0.50mol��L��1��ij����������Mn������Һ10.00mL����0.40mol��L��1��NaOH��Һ12.50mL��ȫ��Ӧ�����ɳ�������n����
A. 1 B. 2 C. 3 D. 4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�������һ�������£����ܷ�����ȥ��Ӧ�����ܷ���ˮ�ⷴӦ����( )
A��CH3Cl B��CH3CH��Br��CH3 C��(CH3)3C��CH2Cl D��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������CO2����ͨ���������Һ�У�Ȼ��������ɣ����ڸ����³�ַ�Ӧ��������õĹ���������
A. Na2SiO3 B. Na2CO3��Na2SiO3 C. Na2CO3��SiO2 D. SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���� �� ��
A. ��ʯīΪ�缫���MgCl2��Һ��2Cl��+2H2O![]() Cl2+H2��+2OH��
Cl2+H2��+2OH��
B. CuC12��Һ�м��백ˮ��Cu2++2OH�� Cu��OH��2��
C. KI��Һ�е���ϡ���ᣬ��������4H++4I��+O2 2I2+2H2O
D. ��NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ�NH![]() +OH��
+OH��![]() NH3��+H2O
NH3��+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com