
【题目】与OH-具有相同质子数和电子数的粒子是( )
A. H2O B. F-
C. Na+ D. NH3
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】2016年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
I.汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g),正反应为放热反应。
2CO2(g)+N2(g),正反应为放热反应。
(1)下列说法正确的是_______________。
A.装有尾气净化装置的汽车排出的气体中一定不再含有NO或CO
B.提高尾气净化效率的最佳途径是研制高效催化剂
C.升高温度可使该反应的正反应速率增大、逆反应速率减小
D.单位时间内消耗NO和CO2的物质的量相等时,反应达到平衡
(2)已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在线面实验设计表中,请在下表中的横线上填出合理数据:
实验编号 | t(℃) | NO初始浓度(10-3mol·L-1) | CO初始浓度(10-3mol·L-1) | 催化剂的比表面积(m2·g) |
① | 280 | 1.20 | 5.80 | 82 |
② | ______ | 1.20 | ______ | 124 |
③ | 350 | ______ | ______ | 82 |
实验①中,NO的物质的量浓度(c)随时间(t)的变化如下图所示。请在给出的坐标图中画出实验②、③中NO的物质的量浓度(c)随时间(t)的变化的曲线______,并标明各曲线的实验编号。
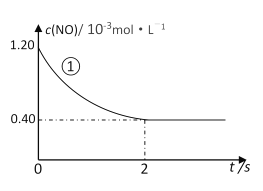
在280℃下,0~2 s内的平均反应速率v(N2) = ________________________。
II.直接排放煤燃烧产生的烟气会引起严重的环境问题。
(3)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原氮氧化物(NOx)可以转化成无毒害的空气组分,从而消除氮氧化物的污染。请写出CH4催化还原NO2的化学方程式:_______________________________________________________。
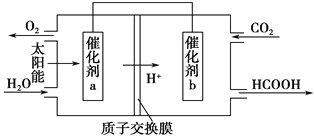
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右上图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂a表面发生_______反应(填“氧化”或“还原”),总反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌片、铜片和稀硫酸组成的原电池,正极上发生的电极反应是
A. 2H++2e-=H2↑ B. Zn-2e-=Zn2+
C. 2H2O+O2+4e-=4OH- D. Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有常温下两种溶液:①0.1mol/LNH3·H2O溶液②0.1mol/LNH4Cl溶液
(1)溶液①的PH______7(填“>”、“<”或“=”),写出NH3·H2O的电离方程式______________。
(2)溶液②呈________性(填“酸”、“碱”或“中”)。
(3)关于两种溶液中c(NH4+)的大小叙述正确的是________(填序号)。
A.两种溶液中c (NH4+)都等于0.lmol/L
B.两种溶液中c (NH4+)都小于0.lmol/L
C.NH4Cl溶液中c(NH4+)小于NH3·H2O溶液中c(NH4+)
(4)将溶液中①逐滴加入溶液②中,当溶液pH=7时,c(NH4+)______ c(Cl一)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两原子,A原子L层比B原子M层少3个电子,B原子L层电子数恰为A原子L层电子数的2倍,则A、B分别是( )
A. 硅和钠 B. 硼和氮
C. 碳和氯 D. 碳和铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并___________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如右图所示,所用盐酸溶液的体积为________mL。
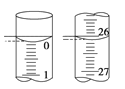
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号内的物质是杂质)时,选用的试剂或方法正确的是( )
A | B | C | D | |
试样 | NaCl溶液(Na2CO3) | NH4Cl固体(I2) | CO2(SO2) | NaBr溶液(Br2) |
除杂试剂 或方法 | 澄清石灰水 | 加热 | NaOH溶液 | 用CCl4萃取、 分液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com