
科目: 来源: 题型:阅读理解
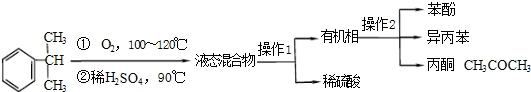
| 物质 | 沸点 | 溶解性 | 主要化学性质 |
| 异丙苯 | 152.4℃ | 不溶于水,易溶于酒精. | 可被强氧化剂氧化 |
| 苯酚 | 181.8℃ | 微溶于冷水,易溶于热水和酒精等有机溶剂. | 易被氧化 |
| 丙酮 | 56.2℃ | 易溶于水和有机溶剂 | 不易被氧化 |
| 检验项目 | 实验方案 |
| 检验丙酮中一定存在有机杂质的方法是 A A |
A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯酚的方案是: | 取少许待测液置于试管中,滴加1~2滴FeCl3溶液.预期的实验现象和结论是 滴加FeCl3溶液后,若试管中溶液变为紫色,则丙酮中含有苯酚;若试管中溶液不变为紫色,则丙酮不含苯酚 滴加FeCl3溶液后,若试管中溶液变为紫色,则丙酮中含有苯酚;若试管中溶液不变为紫色,则丙酮不含苯酚 . |
查看答案和解析>>
科目: 来源: 题型:
 (2013?深圳一模)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如下:
(2013?深圳一模)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如下:

| c(Ca2+) |
| c(Mg2+) |
| 充电 |
| 放电 |
查看答案和解析>>
科目: 来源: 题型:
 (2013?深圳一模)CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
(2013?深圳一模)CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
查看答案和解析>>
科目: 来源: 题型:
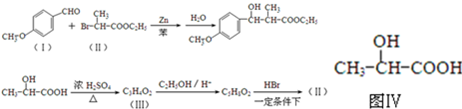
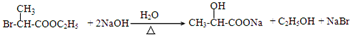

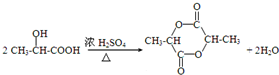

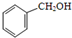

查看答案和解析>>
科目: 来源: 题型:
(2013?深圳一模)Q、W、X、Y、Z都是短周期元素.X、Y、Q在周期表中的位置关系如图.W、Z的最外层电子数相同,Z的核电荷数是W的2倍.则下列说法不正确的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com