
科目: 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH =a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH =a kJ/mol反应过程中测定的部分数据如下表:

①反应0~2min末的平均速率v(COCl2)=_______mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =_______L/ mol。
③已知X、L可分别代表温度或压强,如图表示L一定时,CO的转化率随X的变化关系。
X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。

(2)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的NO转化率如图1所示。温度高于710K时,随温度的升高NO转化率降低的原因可能是____________________。
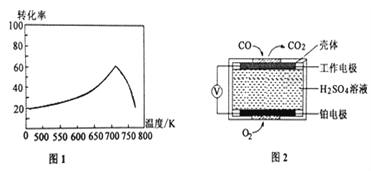
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式______________________。
(3)一定条件下,将CO和H2充入2L密闭容器中反应,可生成甲醚(CH3OCH3)。
4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
下列能判断反应达到平衡的是_______________。
A.υ(H2)=2υ(CO) B.容器内的压强不变
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变
E.甲醚的浓度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关材料的说法不正确的是( )
A. 传统的无机非金属材料虽有不少优点,但质脆,经不起热冲击
B. 新型无机非金属材料虽然克服了传统无机材料的缺点,但强度比较差
C. 高温结构材料具有能受高温、不怕氧化、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点
D. 新型无机非金属材料特性之一是具有电学特性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液蒸干后,能析出溶质固体的是( )
①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3
A.仅①④ B.仅②④
C.仅①② D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是地球上组成生命的最基本元素之一,可以sp3 、sp2和sp杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子核外有__________种空间运动状态的电子,其价电子排布图为 。
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:

试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体:![]() )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
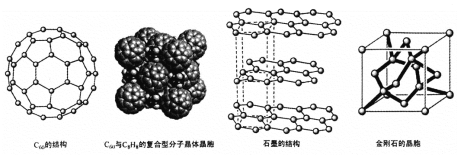
(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg.cm-3 ,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为 cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH═CHR2,被氧化为![]() 和
和![]() ;
; 被氧化为
被氧化为 和
和 ,由此推断分子式为C5H10的烯烃的氧化产物有( )
,由此推断分子式为C5H10的烯烃的氧化产物有( )
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目: 来源: 题型:
【题目】要证明某溶液中不含 Fe3+而可能含Fe2+,进行如下实验操作时的最佳顺序为( )
①加入足量氯水 ②加入足量I2水 ③加入少量KSCN溶液.
A.①③B.③②C.③①D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学反应表达正确的是( )
A. 1-丙醇与浓氢溴酸反应: CH3CH2 CH2OH + HBr ![]() CH3CH2 CH2Br + H2O
CH3CH2 CH2Br + H2O
B. 服用阿司匹林过量出现水杨酸(![]() )中毒反应, 可静脉注射 NaHCO3溶液:
)中毒反应, 可静脉注射 NaHCO3溶液:
![]() + 2 HCO3-→
+ 2 HCO3-→![]() + 2 CO2↑ + 2 H2O
+ 2 CO2↑ + 2 H2O
C. 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
D. 向丙氨酸钠中加入足量盐酸:
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。 |
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_________;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是_________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的_________影响。
③实验Ⅳ中加入Na2SO4溶液的目的是_________。
④为达到丁同学的目的,经讨论,同学们认为应改用右图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是_________。

查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下列事实不能说明NH3·H2O为弱电解质的是( )
A. 0.1 mol·L-1NH3·H2O的pH小于13
B. 0.1 mol·L-1NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol·L-1NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol·L-1NH3·H2O能使无色酚酞溶液变红色
查看答案和解析>>
科目: 来源: 题型:
【题目】几种相邻短周期主族元素的相对位置如表,元素X的原子核外电子数是元素M的2倍,Y的氧化物具有两性。下列说法不正确的是
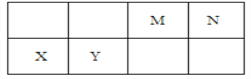
A. 基态Y原子中存在6种能量不同的电子
B. X位于第三周期IIA ,其单质可采用电解熔融其氯化物制备
C. 元素最高价氧化物的水化物中,酸性最强的是HNO3
D. 气体分子(MN)2的电子式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com