
科目: 来源: 题型:
【题目】已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强。它可用于制备苯甲酸乙酯和苯甲酸铜。
(一)制备苯甲酸乙酯
COOH+C2H5OH ![]() COOC2H5+H2O
COOC2H5+H2O
相关物质的部分物理性质如表格:

实验流程如下图:

(1)制备苯甲酸乙酯,装置最合适的是下图中的________(填字母,下同)。

反应液中的环己烷在本实验中的作用____________________。
(2)步骤②控制温度在65~70 ℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热。放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷。反应完成的标志是___________________________________________________________。
(3)步骤③碳酸钠的作用是________________________________________________________。
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25 mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥。乙醚的作用是____________________________________________。
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80 ℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品。
(5)混合溶剂中乙醇的作用是__________________________________________________,
趁热过滤的原因________________________________________________________。
(6)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是________。
A.冷水 B.热水
C.乙醇 D.乙醇水混合溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】理论上不能设计为原电池的化学反应是
A. CH4(g)+2O2(g)==CO2(g)+2H2O(l)
B. HNO3(aq)+NaOH(aq)==NaNO3(aq)+H2O(l)
C. 2H2(g)+O2(g)==2H2O(l)
D. 2FeCl3(aq)+Fe(s)==3FeCl3(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下:

(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为:_________。写出A+B→C的化学反应方程式__________________________。
(2)C 中①、②、③3个—OH的酸性由强到弱的顺序是:_______。
中①、②、③3个—OH的酸性由强到弱的顺序是:_______。
(3)E是由2分子C生成的含有3个六元环的化合物,E的分子中不同化学环境的氢原子有_____种。
(4)D→F的反应类型是______,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为_______mol。写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式____。
①属于一元酸类化合物 ②苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知:![]() 。A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
。A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:

查看答案和解析>>
科目: 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250 ℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=____________。
②已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
CO(g)+H2O (g)===CO2(g)+H2 (g) =2.8 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) =-566.0 kJ·mol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的ΔH=_____________。
2CO(g)+2H2(g) 的ΔH=_____________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是___________________________________________________________________。

②为了提高该反应中CH4的转化率,可以采取的措施是____________________________________。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为________________________________________________。
(3)①Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是________(填字母)。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_________________________________________。
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO![]() CO+H2+O2
CO+H2+O2
高温电解技术能高效实现反应A,工作原理示意图如下:

CO2在电极a放电的反应式是________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题:
(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为:____________;与M同一周期的主族元素中原子半径最小的是(填元素符号)________。
(2)含有元素M的化合物Q是淡黄色固体,写出Q的电子式:______________。
(3)氧化铝溶液与过量氨水反应的离子方程式为____________________________________________;
生成物NH4Cl中存在的化学键类型为_____________________________。
(4)元素X、Y在周期表中位于同一主族,化合物Cu2X和Cu2Y可发生如下转化(其中D是纤维素水解的最终产物):
Cu2X![]() 澄清溶液
澄清溶液![]() 悬浊液
悬浊液![]() Cu2Y(砖红色沉淀)
Cu2Y(砖红色沉淀)
①D的分子式是_____________。
②Cu2Y与过量浓HNO3反应有红棕色气体生成,该反应的化学方程式为:_______________________。
③硒(Se)是人体必需的微量元素,与元素Y同一主族,Se原子比Y原子多两个电子层,则Se的原子序数为_________,其最高价氧化物对应的水化物化学式为_____________________。
该族25周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+99.7 kJ mol-1 b.+29.7 J mol-1 c.-20.6 J mol-1 d.-241.8 J mol-1
表示生成1 mol硒化氢反应热的是___________(填字母代号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料 MnO2(反应条件已省略)。
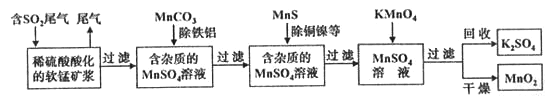
请回答下列问题:
(1)上述流程脱硫实现了____________(选填下列字母编号)。
a.废弃物的综合利用 b.白色污染的减少 c.酸雨的减少
(2)KMnO4+MnSO4→MnO2的反应中,氧化剂与还原剂的物质的量之比为____________。
(3)已知:25℃、101kPa 时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)= MnSO4(s) △H=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式为:_______________________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2其阳极的电极反应式是__________________________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式为:____________________________________________________。若以该电池为电源,以石墨作电极电解CuSO4溶液,阴极析出铜,阳极产物是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B. 用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度
C. 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D. 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关
查看答案和解析>>
科目: 来源: 题型:
【题目】北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
A.K3C60中只有离子键 B.K3C60中不含共价键
C.该晶体在熔融状态下能导电 D.C60与12C互为同素异形体
查看答案和解析>>
科目: 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用,下列叙述正确的是
A. 白酒中混有少量的塑化剂,少量饮用对人体无害,可以通过过滤的方法除去
B. 将猕猴桃和苹果放在一起,猕猴桃更容易成熟。是因为苹果释放的乙烯具有催熟作用
C. 氨气可以做制冷剂,是因为氨气有一定的还原性
D. 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子,才能被人体吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com