
科目: 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是

A. 该反应的△H<0
B. 曲线b代表H2O
C. N点和M点所处状态的c(H2)不一样
D. 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述正确的是
①CS2为V形的极性分子②ClO3-的立体构型为平面三角形
③SF6中有6对完全相同的成键电子对④SiF4和SO32-的中心原子均采用sp3杂化
A.①③B.②④C.①②D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键是 ( )
A.一定是离子键 B.一定是共价键
C.可能是离子键,也可能是共价键 D.以上说法都不正确
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素。其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元索形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的第一电离能从大到小的顺序是_______ (用元素符号表示,下同)。
(2)写出W的价电子排布式________ ,W同周期的元素中,与W原子最外层电子数相等的元素还有_______。
(3)根据等电子体原理,可知化合物XZ的结构式是______,YZ2-的VSEPR模型是________。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是________(用化学式表示),原因是____________________。
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式_______,该物质硬度大,推测该物质为______晶体。其中Y元素的杂化方式是____________。
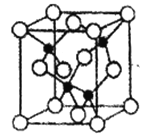
(6)U的晶体属立方晶系,其晶胞边长为405Pm,密度是2.70g·cm-3,通过计算确定其晶胞的类型________________(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(己知:4053=6.64×107)。
查看答案和解析>>
科目: 来源: 题型:
【题目】以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
I.从废液中提纯并结晶出FeSO4·7H2O;
Ⅱ.将FeSO4·7H2O配制成溶液
Ⅲ.将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体;
V.煅烧FeCO3,得到Fe2O3固体
已知:NH4HCO3在热水中分解
(1)I中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是____。
(2)Ⅱ中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用______________。
(3)Ⅲ中,生成FeCO3的离子方程式是________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-的操作是 __________。
(5)已知煅烧FeCO3的化学方程式是:____________。现煅烧464.0 kg FeCO3,得到316.8 kg产品。若产品中杂质只有Fe2O3,则该产品中Fe2O3的质量是____kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员以Zn和尖晶石型锰酸锌(ZnMn2O4)为电极材料,研制出一种水系锌离子电池。该电池的总反应方程式:xZn + Zn1xMn2O4![]() ZnMn2O4(0 < x < 1)。下列说法正确的是
ZnMn2O4(0 < x < 1)。下列说法正确的是
A. 充电时,Zn2+向ZnMn2O4电极迁移
B. 充电时,阳极反应:ZnMn2O4 2xe—=Zn1-xMn2O4+xZn2+
C. 放电时,每转移1mol e-,ZnMn2O4电极质量增加65g
D. 充放电过程中,只有Zn元素的化合价发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为______________;
②该反应的热化学方程式为________________________________;
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=____________kJ·mol-1;
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
(3)倒入NaOH溶液的正确操作是_______________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.一次迅速倒入 C.分三次少量倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是_________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:___________。(任意写出一点)
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设①该反应的气体产物是CO2;②该反应的气体产物是CO。
③该反应的气体产物是 。
(2)设计方案,如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

(3)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: 。
(6)实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com