
科目: 来源: 题型:
【题目】锌与稀硫酸反应,下列说法错误的是( )
A. 加热可加快反应速率 B. 增大稀硫酸的浓度可加快反应速率
C. 粉碎锌粒可加快反应速率 D. 提高锌的纯度可加快反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A.所有的化学反应都有能量变化
B.需要加热的反应一定是吸热反应
C.所有的放热反应都可以在常温常压下自发进行
D.核能作为一种反应热,是理想的新能源
查看答案和解析>>
科目: 来源: 题型:
【题目】(18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。

③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 molL1碘的标准溶液滴定。
反应原理为:2S2O32+I2=S4O62-+2I
(5)滴定至终点时,溶液颜色的变化: 。
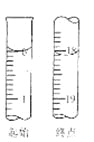
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O35H2O相对分子质量为M) 。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42,常用作脱氧剂,该反应的离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
(1)写出B2O3与NH3反应生成BN的方程式___________________________
(2)基态N原子的价层电子排布式为_________。
(3)B、N、O相比,第一电离能最大的是_______,BN中B元素的化合价为_____
(4)SO42–中S原子的杂化轨道类型为_______,O—S—O的键角是_______,写出一个与SO42–等电子体的微粒_______。
(5)BF3能与NH3反应生成BF3NH3,BF3分子的分子构型为_______,BF3NH3中BF3与NH3之间通过___________(填“离子键”、“ 配位键”或“氢键”) 结合。
查看答案和解析>>
科目: 来源: 题型:
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,(1)传统上该转化通过如右图所示的催化剂循环实现,

其中,
反应①为2HCl(g)+CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1 mol Cl2的反应热为△H2,则总反应的热化学方程式为_______________________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl-T曲线如图所示,则总反应的△H_____0 ,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______________。

②在上述实验中若压缩体积使压强增大,画出相应ɑHCl~T曲线的示意图,并简要说明理由__________。
(3)①下列措施中有利于提高ɑHCl的有_____________。
A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O
②一定条件下测得反应过程汇总n(Cl2)的数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0 min内以HCl的物质的量变化表示的反应速率为_______________(以mol·min-1为单位)。
(4)Cl2用途广泛,写出Cl2制备漂白粉的化学方程式__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上或实验室提纯以下物质的方法中不合理的是(括号内为杂质)
A.溴苯(溴):加NaOH溶液,分液
B.苯(甲苯):加入浓溴水,分液
C.乙醇(水):加新制生石灰,蒸馏
D.乙酸乙酯(乙酸、乙醇):加饱和碳酸钠溶液,分液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于碱金属的原子结构和性质的叙述不正确的是
A. 碱金属元素的原子在化学反应中容易失去电子
B. 碱金属单质都是强还原剂
C. 碱金属单质都能在O2中燃烧生成过氧化物
D. 碱金属单质都能与水反应生成碱
查看答案和解析>>
科目: 来源: 题型:
【题目】
早期发现的一种天然二十面体准晶颗粒由三种Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有_________个未成对电子,Fe3+的电子排布式为_______________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为_______________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为____________,乙醛分子中各元素的电负性由大到小的顺序为_______________。乙酸的沸点明显高于乙醛,其主要原因是_____________________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为__________。列式表示Al单质的密度_______________ g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com