
科目: 来源: 题型:
【题目】下列因果关系的判断正确的是
A. 因为反应时铝原子失去的电子比钠原子多,所以铝原子的还原性比钠原子强
B. 因为NaOH能中和H+,所以可以治疗胃酸过多
C. 因为氯水具有漂白性,所以可以使酸性KMnO4溶液褪色
D. 因为SO2溶于水生成亚硫酸,所以可以使石蕊变红
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液中:K+、AlO2-、Cl-、SO42-
B. 强酸性溶液中:K+、SO42-、Fe2+、NO3-
C. 与铝反应产生大量氢气的溶液中:Na+、CO32-、NO3-、K+
D. 某无色溶液中:Fe3+、Cl-、Na+、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下面的反应路线及所给信息,回答下列问题:
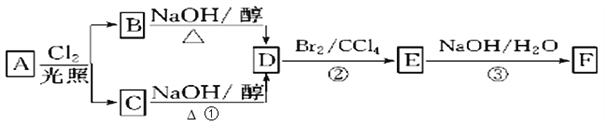
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88gCO2和45gH2O,A的分子式是________________。
(2)B和C均为一氯代烃,已知C中只有一种等效氢,则B的名称(系统命名)为_______。
(3)D的结构简式_____________, ③的反应类型是 ______________。
(4)写出③的反应化学方程式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及其化合物转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不全部是通过一步反应完成的是( )。
A. Na→NaOH→Na2CO3→NaCl B. Fe→Fe(NO3)3→Fe(OH)3→Fe2O3
C. Mg→MgCl2→Mg(OH)2→MgSO4 D. Al→Al2O3→Al(OH)3→AlCl3
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_________。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除![]() 外还可能含有
外还可能含有![]() 。若要确认其中的
。若要确认其中的![]() ,应先用_______(选填序号)。
,应先用_______(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性![]() 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
![]() 然后加入足量
然后加入足量![]() 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中![]() 的体积分数为____________。
的体积分数为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,室温下分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2 和O2 的混合气体,若将H2、O2 的混合气体点燃引爆。活塞先左弹,恢复室温后,活塞右滑停留于容器的中央。则原来H2、O2 的物质的量之比可能为①4∶5 ② 2∶5 ③3∶8 ④7∶2

A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】已知
Fe(s)+CO2(g)![]() FeO(s)+CO(g) K1 ①
FeO(s)+CO(g) K1 ①
Fe(s)+H2O(g)![]() FeO(s)+H2(g) K2 ②
FeO(s)+H2(g) K2 ②
H2(g)+CO2(g)![]() H2O(g)+CO(g)K3 ③
H2O(g)+CO(g)K3 ③
又已知不同温度下,K1、K2值如右表:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)判断反应③达到化学平衡状态的依据是____________。
a.混合气体的平均摩尔质量不变
b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆
d.断裂2 mol H—O键的同时生成1 mol H—H键
(2)若500 ℃时进行反应①,CO2起始浓度为2 mol·L-1,2分钟后建立平衡,则CO2转化率为________,用CO表示的速率为________________。
(3)下列图象不符合反应②的是___________(填序号)(图中v是速率,φ为混合物中H2的体积百分含量)。

(4)900 ℃进行反应③,其平衡常数K3为____________(求具体数值),焓变ΔH__________0(填“>”“=”或“<”),理由是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温条件下,下列有关电解质溶液的描述正确的是
A.等浓度的KHSO3溶液与KOH溶液等体积混合:c(OH)c(H+)=c(![]() ) + c(H2SO3)
) + c(H2SO3)
B.pH相同的氨水和Ba(OH)2溶液中:2c(![]() )= c(Ba2+)
)= c(Ba2+)
C.等浓度的Na2SO4溶液与NH4Cl溶液等体积混合:c(Na+) +c(![]() )+c(NH3·H2O)=2c(
)+c(NH3·H2O)=2c(![]() ) +c(Cl)
) +c(Cl)
D.1 L 0.1 mol·L1的KAl(SO4)2·12H2O溶液中:c(K+)+c(Al3+)+c(H+)=c(OH)+c(![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2![]() 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(2)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(3) 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。
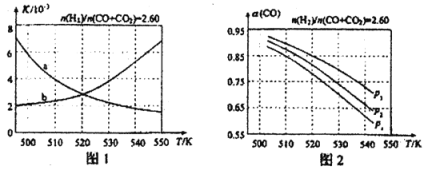
(4)合成气的组成n(2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 标准状况下,1mol H2O的体积约为22.4L
B. 11g CO2和5.6L N2所含分子数相同
C. 常温常压下,22.4L H2的物质的量小于1mol
D. 决定气体摩尔体积的主要因素是分子的大小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com