
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 某人的血糖检测结果为90mg/dL(毫克每0.1升),他的血糖是正常(人的血糖正常值在3.61----6.11mmol/L,血糖相对分子质量180)
B. 用点燃的火柴在液化气钢瓶口检验是否漏气
C. 当光束通过有尘埃的空气、氯化铁溶液、墨水等分散系能观察到丁达尔现象
D. 胶体属于介稳体系原因是胶体带电
查看答案和解析>>
科目: 来源: 题型:
【题目】对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用做防腐剂,对酵母和霉菌具有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化作用下进行酯化反应而制得。以下是某课题组幵发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:

已知以下信息:
①通常在同一个碳原子上连有两种羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
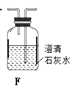
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶1。
回答下列问题:
(1)A的化学名称为___________;
(2)由B生成C的化学反应方程式为________________________;该反应的类型为_________;
(3)D的结构简式为____________; F的分子式为_____________;
(4)G中所含官能团的名称_________;
(5)E的同分异构体中含有苯环且能发生银镜反应的共有_______种,其中核磁共振氧谱有三种不同化学环境的氢,且峰面积比为2∶2 ∶1的是_____________________(写结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B为气体单质,其中一种为黄绿色,二者反应生成气体C;D为常见金属单质,E溶液为浅绿色,它们之间有下列转化关系:

(1)写出C的溶液与D反应的离子方程式:___________。
(2)写出A通入E溶液生成F的离子方程式:___________。
(3)E溶液中含有F,除去F应加入试剂________,反应的离子反应方程式为:___________。
(4)检验F中的阳离子时,可加入试剂X的溶液,现象是:______________。X试剂的化学式是:___________________,
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为___________(填字母序号)。


![]()


(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B的离子方程式_____________________________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”?____________(选填“能”或“不能”);简述你的理由:__________________________________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____________(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.00mL。
①所用指示剂为_______________;滴定终点时的现象为_________________________;
②H2C2O4溶液物质的量浓度为_______________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A. 滴定管在盛装NaOH溶液前未润洗
B. 滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C. 滴定前读数正确,滴定终点时俯视读数
D. 滴定前读数正确,滴定终点时仰视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3、KNO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤后溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量硝酸酸化的AgNO3溶液产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是________,一定不含的物质是________,可能含有的物质是________。(以上各种物质均写化学式)
(2)写出下列步骤中发生反应的离子方程式:
①_______________________________________________________;
②_______________________________________________________;
④_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g) ![]() 2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:

(1)上图中属于氢气物质的量随时间变化的曲线是_____________(填“I”、“II”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是______。
A.t2时该反应达到平衡状态 b.t2时II和III代表的物质反应速率相同
c.t2时氢气、氮气与氨气的反应速率之比为3:1:2 D.t2时氨气与氢气的物质的量相同
(3)对于II所代表的物质,其逆反应速率最大的点是__________(填“c”、“d”或“g”);对于I所代表的物质,其正反应速率最小的点是___________ (填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是____________(填序号)。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,—定条件下建立平衡:N2(g) + 3H2(g) ![]() 2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸厂烧渣(主要成分是Fe2O3,其次含少量的SiO2和FeS)经回收处理可制得绿矾(FeSO4·7H2O)和一种重要的水处理剂聚铁胶体[Fe(OH)SO4]n,上述生产工艺流程如下:

请通过分析回答下列相关问题:
(1)操作Ⅰ的名称是 _____。
(2)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是____________。
A.直接用水吸收 B. 用氨水吸收
C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收
(3)操作Ⅲ经蒸发浓缩、___________、过滤、____、干燥等。
(4)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是_________。
(5)检验溶液X中金属阳离子所加试剂是______,其现象是___________ 。
(6)溶液X转化为溶液Y需加入一种常见物质是 ____________ 。
(7)在反应釜中FeS、O2及稀H2SO4反应生成硫酸铁等物质,则反应的离子方程式是________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能用能量判据判断下列过程的方向的是( ).
A. 水总是自发地由高处往低处流
B. 放热反应容易自发进行,吸热反应不能自发进行
C. 有序排列的火柴散落时成为无序排列
D. 多次洗牌以后,扑克牌的毫无规律的混乱排列的概率大
查看答案和解析>>
科目: 来源: 题型:
【题目】“霾”是当今世界环境热点话题。目前我国许多地方空气质量恶化原因之—是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-akJ·mol-1 (a>0)
2CO2(g)+N2(g) △H=-akJ·mol-1 (a>0)
(1)在一定温度下,将2.0 mol NO、2.4 mol CO气体通入到固定容积为2L的密闭容器中,
反应过程中部分物质的浓度变化如图所示:

① 015 min N2的平均速率v(N2)=_______;NO的转化率为 _______。
②20 min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_______(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的溫度不变,20 min时再向容器中充入NO、N2各0.4mol,化学平衡将________移动(选填“向左”、“向右”或“不”),重新达到平衡后,该反应的化学平衡常数为___________。
(2)已知:2NO(g)+O2(g)=2NO2(g) △H=-bkJ·mol-l (b>0)CO的燃烧热△H=-ckJ·mol-l(c>0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应的热化学反应方程式为______________。
(3)工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示。Pt乙为_______极,电解池中生成N2O5的电极反应式是_________。

查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为:C2++2e-→C,B-2e-→B2+则A、B、C、D金属性由强到弱的顺序为( )
A.A>B>C>DB.A>B>D>CC.D>A>B>CD.D>C>A>B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com