
科目: 来源: 题型:
【题目】化学与生活、生产密切相关。下列说法正确的是
A. KA1(SO4)2·12H2O常用于杀菌消毒
B. 生活中可用无水乙醇消毒
C. 纤维素在人体内水解得到葡萄糖
D. 泡沫灭火器中的反应物是NaHCO3和Al2(SO4)3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列A、B、C三图表示酶浓度一定时,反应速率和反应物浓度、温度、pH的关系,请据图回答下列问题.

(1)图A中,反应物达到某一浓度时,反应速率不再上升,此时若想提高反应速率可以采取的措施有调整为最适温度、最适pH值和 等.
(2)图C中,pH是 时降低活化能最多
(3)图B中,同一组酶,温度由50逐渐降到30时酶的活性 .
(4)B、C两图反映的酶的特性是 .
(5)要验证温度对酶活性影响能不能用过氧化氢溶液做底物 (“能”或“不能”),若是用唾液淀粉酶来验证温度对酶活性的影响,能不能用斐林试剂检测产物 (“能”或“不能”).
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 3Z(g)。此反应达到平衡的标志是( )
3Z(g)。此反应达到平衡的标志是( )
A. 容器内压强不随时间变化
B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为l:2:3
D. 单位时间消耗0.1molX同时生成0.3molZ
查看答案和解析>>
科目: 来源: 题型:
【题目】为了检测酶X在37℃时对三种二糖(糖A、糖B、糖C)的作用,设计了如图所示的实验.5min后检测每只试管中的单糖和二糖,结果如下表.
试管1 | 试管2 | 试管3 | |
单糖 | 无 | 无 | 有 |
二糖 | 有 | 有 | 无 |

(1)一般来说,酶的基本组成单位是 .
(2)从本实验中,可得出的结论是: .
(3)为进一步检测该酶与pH的关系,请用下面所给的材料和实验室中的基本设备,设计一个实验,探究pH对酶活性的影响.
实验材料:酶X,糖A溶液、糖B溶液、糖C溶液(自选一种),斐林试剂,不同pH的物质(酸、水、碱).
实验步骤:
①取三支洁净试管,向三支试管中均加入1mL的酶X溶液,编号为A、B、C.
②向A试管中加入1mL ,向B试管中加入1mL ,向C试管中加入1mL ,摇匀.
③将 溶液各2mL注入到A、B、C三支试管中,置于 中保温5min.
④在各支试管中分别加入适量的 ,然后水浴加热5min,观察颜色变化.
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应” 的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有 熔融物落人沙中”。査阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | — |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理:________(填“合理”或“不合理”)。
(2)设汁一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为___________。
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。若铁被氧化为Fe3+,在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。

回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为____________。在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____________。
(2)B与A的差值为_________mol。B点对应的沉淀的物质的量为___________mol,C点对应的氢氧化钠溶液的体积为____________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知硒元素的核电荷数为34,下列关于78Se的说法正确的是( )
A. 78Se的核内有78个质子 B. 78Se的质量数是44
C. 78Se的核内有34个中子 D. 78Se的核外有34个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如下图所示:

(1)若要从FeCl3溶液中提取晶体,在必须进行的实验操作步骤中,没有用到的玻璃仪器有________________(填字母)。
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(2)装置A中的现象是__________________,写出B中发生反应的离子方程式:__________________。
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下试验
方案①:向第一份溶液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是_______________(填序号)。
(Ⅱ)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸。选择下面的装置和药品来探究亚硫酸与次氯酸的酸性强弱。

(4)装置正确的连接顺序为A、________________________________、D、F,其中装置B的作用是_________。证明亚硫酸的酸性强于次氯酸的现象为_____________________________。
(Ⅲ)某同学对SO2与漂粉精的反应进行了实验探究。
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| ①溶液出现浑浊,并变为黄绿色 ②稍后,产生大量白色沉淀,黄绿色褪去 |
(5)C12和Ca(OH)2反应制取漂粉精的化学方程式是______________________________________。
(6)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________________。
(7)现象①中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分ClO-和Cl-发生反应。写出漂粉精在酸性条件下发生反应的离子方程式:_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某农场在田间试验时发现,小麦产量总是比邻近的地块低,技术员怀疑该农田可能缺乏某种元素.现将该农田分成面积相等的5块样地,分别编为1~5号进行试验.除施肥不同外,其他条件相同,结果如图所示.分析判断该农田最可能缺乏的元素是( )
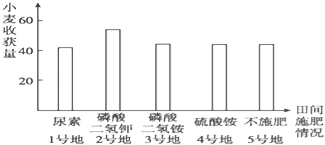
A. K B. N C. P D. S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com