
科目: 来源: 题型:
【题目】欲配制250mL0.1molL﹣1的H2SO4溶液,回答下列有关问题,有如下操作步骤:
①把量取好的浓H2SO4沿烧杯壁缓缓倒入盛有一定量水的小烧杯中,并用玻璃棒不断搅拌
②把①中所得溶液小心转入仪器A中
③继续向A中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入A中,并轻轻摇匀
⑤用玻璃塞将A塞紧,充分摇匀
请填写下列空白: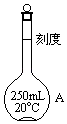
(1)写出图中仪器A的名称 , 使用此仪器A前应检查它是否 .
(2)操作步骤的正确顺序为(填序号) .
(3)转移溶液时,应先将溶液 , 然后将溶液沿玻璃棒注入仪器A中.
(4)若出现下列操作时,对所配溶液浓度将有何影响(填“偏高、偏低、无影响”)
①量筒用蒸馏水冼净后,再量取浓硫酸;
②不将洗涤液转移入仪器A就定容;
③定容时,仰视仪器A刻度线;
④仪器A只用蒸馏水洗涤,但未经干燥而配制溶液 .
(5)若实验过程中出现如下情况应如何处理?
①加蒸馏水时不慎超出了刻度;
②向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面 .
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中常用氧化浓盐酸的方法制取氯气,实验装置如图所示: 
(1)装浓盐酸的仪器名称:;
(2)为了得到纯净、干燥的氯气,此装置还需增加净化装置,请根据气体的流动方向,依次按顺序选择所用的装置,正确的选项是; 
(3)如果将过量二氧化锰与20mL 12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有:①;② .
(4)多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置; 
(5)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的一种溶液,有关的化学方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】加热N2O5依次发生的分解反应为:
①N2O5(g) ![]() N2O3(g)+O2(g)
N2O3(g)+O2(g)
②N2O3(g) ![]() N2O(g)+O2(g)
N2O(g)+O2(g)
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则平衡体系中N2O5的物质的量浓度为
A. 1.8mol/L B. 0.9 mol/L C. 2.3 mol/L D. 4.0 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如下:

已知:

冋答下列问题:
(1) F中含氧官能团的名称是_______;
(2) 质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:___________________。
(3) 当试剂d过量时,可以选用的试剂d是______(填字母序号)。
a. NaHCO3 b. NaOH c. Na2CO3 d. Na
(4) 写出C与NaOH反应的化学方程式________________。
(5)肉桂酸有多种同分异构体,符合下列条件的有______种。
a.苯环上有三个取代基;
b.能发生银镜反应,且1mol该有机物场多生成4mol Ag.
由上述符合条件的同分异构体中,写出苯环上有两种不同化学环境氢原子的有机物的结构简式(任写一种即可)____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大,X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)M在元素周期表中的位置为____________。
(2)X 与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)_______,在实验室中,制取该物质的反应原理是(写化学方程:式)________。
(3)MX与水反应可放出气体,该反应的化学方程式为____________。.
(4)常温下不能与G的单质发生反应的是(填序号)_________。
a.CuSO4溶液 b. Fe2O3 c.浓硫酸 d. NaOH溶液 e. Na2CO3固体
(5)工业上若以石墨为电极电解制G的单质,阳极产生混合气体的成分是(写化学式)______。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应mA(g)十nB(g)![]() pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是

A.b1>b2 ,t1>t2
B.两图中阴影部分面积一定相等
C.A的平衡转化率(II)大于(Ⅰ)中A的转化率
D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大
查看答案和解析>>
科目: 来源: 题型:
【题目】欲配制250mL0.1molL﹣1的H2SO4溶液,回答下列有关问题,有如下操作步骤:
①把量取好的浓H2SO4沿烧杯壁缓缓倒入盛有一定量水的小烧杯中,并用玻璃棒不断搅拌
②把①中所得溶液小心转入仪器A中
③继续向A中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入A中,并轻轻摇匀
⑤用玻璃塞将A塞紧,充分摇匀
请填写下列空白:
(1)写出图中仪器A的名称 , 使用此仪器A前应检查它是否 .
(2)操作步骤的正确顺序为(填序号) .
(3)转移溶液时,应先将溶液 , 然后将溶液沿玻璃棒注入仪器A中.
(4)若出现下列操作时,对所配溶液浓度将有何影响(填“偏高、偏低、无影响”)
①量筒用蒸馏水冼净后,再量取浓硫酸;
②不将洗涤液转移入仪器A就定容;
③定容时,仰视仪器A刻度线;
④仪器A只用蒸馏水洗涤,但未经干燥而配制溶液 .
(5)若实验过程中出现如下情况应如何处理?
①加蒸馏水时不慎超出了刻度;
②向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面 .
查看答案和解析>>
科目: 来源: 题型:
【题目】MnSO4在工业中有重要应用,用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:


【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)向软锰矿浆中通入SO2生成MnSO4,该反应的化学方程是___________。
(2)加入MnO2的主要目的是___________;
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调至____范围,生成的沉淀主要含有____和少量CaSO4。
(4) 阳离子吸附剂可用于主要除去的离子是______________。
(5) 用惰性电极电解MnSO4溶液,可以制得高活性MnO2。电解MnSO4、ZnSO4和H2SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质露置于空气中易变质的是 ( )
①氯水 ②水玻璃 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠
A. ①②③④⑥ B. ①④⑤⑥
C. ①④⑤ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com