
科目: 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙.
【查阅资料】
Ⅰ.金属Ca的部分性质有:
①常温或加热条件下Ca都能与氧气反应;
②Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③Ca+H2 ![]() CaH2(固体)
CaH2(固体)
Ⅱ.固体CaH2的部分性质有:
①常温:CaH2+2H2O=Ca(OH)2+2H2↑; ②CaH2要密封保存.
(1)【进行实验】
该小组同学设计的制取装置如图所示(固定装置略).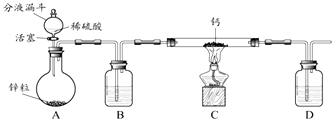
回答下列问题:
(i)写出Ca常温遇水发生反应的化学方程式: .
(ii)B、D中所盛试剂相同,该试剂为(填名称);D中该试剂的作用是 .
(iii)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: .
(2)【实验反思】
该小组同学通过反思提出问题:上述制得的CaH2是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2样品,按图所示连接仪器(固定装置略).
步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL.
(iv)若该实验条件下的气体摩尔体积为Vm L/mol,当V=mL时(用m、Vm表示),表明制得的CaH2样品是纯净的.
查看答案和解析>>
科目: 来源: 题型:
【题目】利用催化技术可将汽车尾气中的 NO和 CO转变成CO2和N2,化学方程式:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:

下列说法中不正确的是( )
A. 2 s内的平均反应速率 v(N2)=1.875×10-4 mol·L-1·s-1
B. 在该温度下,反应的平衡常数 K=5
C. 若将容积缩小为原来的一半, NO 转化率大于 90%
D. 使用催化剂可以提高整个过程中 CO 和 NO 的处理量
查看答案和解析>>
科目: 来源: 题型:
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如图: 
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如图所示:
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: .
(2)欲制备10.7g NH4Cl,理论上需NaCl质量为g.
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 .
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图: 
(1)操作①是利用胶体不能通过而把淀粉胶体和溶液进行分离.
(2)写出上述实验过程中所用试剂的化学式:试剂①;试剂③ .
(3)判断试剂①已过量的操作是: .
(4)控制试剂③适量的方法是: .
(5)试剂②的作用(用化学方程式表示): .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于自然界中氮循环(如右图)的说法不正确的是( )

A. 氮元素均被氧化 B. 工业合成氨属于人工固氮
C. 含氮无机物和含氮有机物可相互转化 D. 碳、氢、氧三种元素也参加了氮循环
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验设计的步骤及现象均正确的是( )
选项 | 实验目的 | 实验步骤及现象 |
A | 证明氯水有酸性 | 试样 |
B | 检验某红棕色气体是否为溴蒸气 | 试样 |
C | 证明酸性条件下H2O2氧化性比 I2强 | NaI |
D | 比较: Ksp(AgCl)>Ksp(AgI) | AgNO3 溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。

(1)装置 A 中仪器a的名称为 ____________。
(2)选用图6中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按 A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是_________________________。
②丙同学设计的合理实验方案为:按照 A→C→____ →E→_____ →F→尾气处理(填字母)顺序连接装置。 E装置的作用是________,证明亚硫酸的酸性强于次氯酸的实验现象是_______ 。
(3)为了测定装置A残液中SO2的含量,量取10.00mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00mL0.0500mol/L的酸性KMnO4溶液吸收。充分反应后,再用0.2 000mol/L的K I标准溶液滴定过量的 KMnO 4,消耗 KI溶液15.00mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I- +2MnO4-+16H+=2Mn 2+ +5I 2+8H2O
①残液中SO 2 的含量为_______ g·L-1。
②若滴定过程中不慎将 KI标准溶液滴出锥形瓶外少许,使测定结果______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com