
科目: 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置.
如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
(1)氢氧燃料电池的能量转化的主要形式是由 , 在导线中电子流动方向为(用a、b表示).
(2)负极反应式为 .
(3)电极表面镀铂粉的原因是 .
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ2Li+H2 ![]() 2LiH
2LiH
ⅡLiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是 , 反应Ⅱ中的氧化剂是 . (均填化学式)
②已知LiH固体密度为0.82g/cm3 , 用锂吸收224L(标准状况)H2 , 则被吸收的H2体积与生成的LiH体积比为 .
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是
A. 不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B. 使用容量瓶配制溶液时,仰视刻度线定容后所得溶液浓度偏高
C. 配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D. 用锡焊接的铁质器件,焊接处易生锈
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A. 氯气作水杀菌消毒剂
B. 硅胶作袋装食品的干燥剂
C. 二氧化硫作纸浆的漂白剂
D. 氯化铁溶液用于铜制印刷线路板制作
查看答案和解析>>
科目: 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下.请回答下列问题: 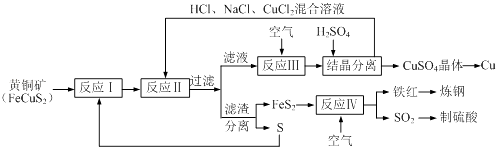
(1)反应Ⅲ的离子方程式为4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O,CuCl2﹣中铜元素的化合价为 , 该反应中的氧化剂是 .
(2)一定温度下,在反应Ⅲ所得的溶液中加入硫酸,可以析出硫酸铜晶体而不析出氯化铜晶体,其原因可能是 .
(3)炼钢时,可将铁红投入熔融的生铁中,以降低生铁的含碳量,该过程中主要反应的化学方程式是 .
(4)SO2尾气直接排放到大气中造成环境污染的后果是 .
(5)已知反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣═2CuCl2﹣+S,反应Ⅰ的产物为和 . (填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾是一种重要的氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3、SiO2、Al2O3)为原料生产。实验室模拟工业法用铬铁矿制重铬酸钾(K2Cr2O7)的主要工艺如下:
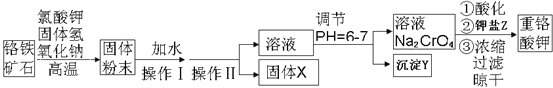
试回答下列问题:
(1)以上工艺流程所涉及元素中属于过渡元素的有_________。铁在周期表的位置是_________。
(2)煅烧前应将铬铁矿充分粉碎,其目的是___________________________。
如在实验室中将铬铁矿和NaOH固体混合物灼烧,从以下各实验仪器中选择必要有_________。
A.陶瓷坩埚 B.铁坩埚 C.三脚架 D.泥三角
(3)操作Ⅱ的名称是__________________。
(4)固体X的主要成分是__________________,沉淀Y的主要成分是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关氧化还原反应的理解正确的是( )
A. 在一定条件下,氯酸钾与碘发生反应KClO3+I2=2KIO3+Cl2 由此判断氧化性 I2>Cl2
B. 已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O其中1mol氧化剂在反应中得到的电子为12 mol
C. (NH4)2SO4在高温下分解生成 SO2、H2O、N2和 NH3。则该反应的氧化产物:还原产物=1:3
D. 在反应2CuFeS2 + O2 = Cu2S + 2FeS + SO2中,若有1molO2参加反应,则反应中有4mol电子转移
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选 项 | 实验操作 | 实验现象 | 结论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
B | 用湿润的淀粉碘化钾试纸检验气体Y | 试纸变蓝 | 气体Y可能是Cl2 |
C | 常温时将打磨过的铝箔插入浓硝酸中 | 无明显现象 | 铝与浓硝酸不反应 |
D | 向稀溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液X中无NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①_______________________;②_______________________;③_______________________。
(2)溶液中共有_______种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L1的是____________,浓度为0.002 mol·L1的是____________。
(4)____________和____________两种粒子物质的量之和等于0.01 mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
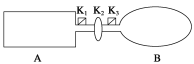
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”)。
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深。
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com