
科目: 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):
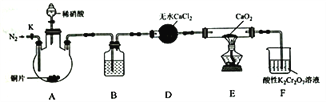
已知:2NO+CaO2 =Ca(NO2)2;2NO2+CaO2=Ca(NO3)2。
请回答下列问题:
(1)将分液漏斗中的稀硝酸滴入三颈烧瓶中的操作为______________。
(2)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因为_________________。
(3)装置D中的仪器名称为_______________。装置B所加试剂为_______________。
(4)装罝F中,酸性K2Cr2O7溶液可将剩余的NO氧化为NO3-,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式为_________________。
(5)已知:Ca(NO2)2溶液遇酸会产生NO气体。设计实验证明装置E中有亚硝酸钙生成:____________。
(6)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化空气,又能获得应用广泛的 Ca(NO2)2,反应原理为Ca(OH)2 + NO+NO2=Ca(NO2)2 + H2O。
①若n(NO):n(NO2)>l:l,则会导致______________________________。
②若n(NO):n(NO2)<1:1,则会导致________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质分离(括号内的物质为杂质)的方法错误的是( )
A.硝基苯(苯)--蒸馏
B.乙烯(SO2)--氢氧化钠溶液
C.己烷(己烯)--溴水,分液
D.乙酸乙酯(乙醇)--碳酸钠溶液,分液
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74×10-3 | |
下列说法不正确的是( )
A. 该反应正反应为吸热反应
B. 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C. 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D. 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 离子化合物中只能含离子键,不能有共价键
B. 非金属元素之间形成的化学键一定是共价键
C. 电子数相同的两种微粒一定是同一元素
D. 化学键被破坏的变化不一定是化学变化
查看答案和解析>>
科目: 来源: 题型:
【题目】印刷电路板在科技领域具有不可替代的作用,它的制备方法为高分子化合物和铜箔压合,通过FeCl3溶液“腐蚀”而成。某实验小组在实验室用废弃的印刷电路板和“腐蚀液”提取铜的一种工艺流程如下:
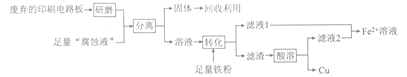
请回答下列问题:
(1) 检验“腐蚀液”中含有Fe2+的方法为_________________。
(2)“分离”所用的操作名称为____________,该操作所用的主要玻璃仪器有烧杯、_____________。
(3)用电解法在铁上镀铜时,阴极材料为_____________(填化学式),理论上电镀过程中电解质溶液的浓度_______________ (填“增大”“减小”或“不变”)。
(4) Fe2+溶液有很多重要用途。
①已知:常温下,Ksp[Fe(OH)2]=1.8×10-16。保存1.8mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊,应调节溶液的pH不超过_________________。
②Fe2+可使Ag+与Fe3+之间相互转化。一定温度下,0.1 mol·L-1的Fe(NO3)2溶液中,c(Fe3+)与c(Ag+)的关系如图所示:
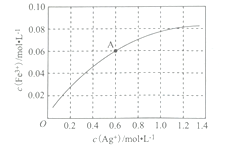
该温度下,A点溶液中转化反应的平衡常数为____________(溶液体积变化忽略不计);若将0.6mol·L-1 Fe(NO3)2溶液、0.15 mol·L-1 Fe(NO3)3溶液、0.06 mol L-1 AgNO3溶液等体积混合后,再加入1.08 g Ag,可观察到的现象为_________________________。
③Fe2+转化为Fe3+后,可用于制备高铁酸盐。向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s) △H= - 444.3kJ/mol,在常温常压下能自发进行,对反应的方向起决定性作用的是
A. 焓变 B. 温度 C. 压强 D. 熵变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的有( )个
①反应速率用于衡量化学反应进行的快慢
②可逆反应达到化学平衡状态时,正、逆反应速率都为0
③决定反应速率的主要因素是反应物的性质
④适当增大反应物浓度,提高反应温度都能增大反应速率
⑤不管什么反应使用催化剂,都可以加快反应速率 ,并可以使平衡移动。
⑥可逆反应A(g)![]() B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大
A. 2 个 B. 3 个 C. 4 个 D. 5个
查看答案和解析>>
科目: 来源: 题型:
【题目】若用AG来表示溶液的酸度,其表达式为:AG=lg[![]() ]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
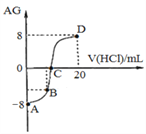
A. 该滴定实验最好选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 滴定过程中从A点到D点,溶液中水的电离程度先逐渐减小,后逐渐增大
D. 若B点加入的盐酸溶液体积为5mL,则所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示的铜﹣锌原电池中, 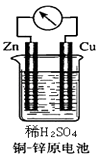
(1)原电池的电极反应式是:正极: , 负极:;
(2)若生成的氢气在标况下的体积为4.48L,则反应过程中有mol电子转移.在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率(选填“要快”、“要慢”、“相等”、“无法确定”).
(3)若根据氧化还原反应Cu+2Ag+═Cu2++2Ag 来设计原电池,则次原电池的负极材料应选 , 电解质溶液应为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com