
科目: 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有希望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,1 molH2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ![]() H=+890.3kJ·mol-1
H=+890.3kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ![]() H= - 890.3 kJ·mol-1
H= - 890.3 kJ·mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ![]() H=890.3 kJ
H=890.3 kJ
D. 2H2(g)+O2(g)=2H2O(l) ![]() H=-285.8 kJ·mol-1
H=-285.8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某电解精炼铜的阳极泥经预处理后主要含有TeO2和少量Ag、Au,以此预处理阳极泥为原料制备单质碲的一种工艺流程如下:

已知TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱分别生成Te4+和TeO32-。回答下列问题:
(1)阳极泥预处理时发生反应: Cu2Te+O2→CuO+TeO2,Cu2Te中Te的化合价为_____,该反应中氧化剂与还原剂的物质的量之比为_________。
(2)“过滤I”所得滤液中,阴离子主要有_______,要从滤渣1中分离出Au,可以向滤渣中加入的试剂是_________。
(3)步骤②控制溶液的pH为4.5~5.0,反应的化学方程式为________,防止酸度局部过大的操作是____________。
(4)步骤④发生反应的离子方程式是____________。
(5)高纯碲的制备采用电解精炼法。将上述流程得到的粗碲溶于NaOH溶液配成电解液,用适当的电极进行电解,阳极产生的气体是____,阴极上的电极反应式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其反应速率________(填“增大”、“不变”或“减小”,下同)。
(2)将容器的体积缩小一半,其反应速率____________。
(3)保持体积不变,充入N2使体系压强增大,其反应速率____________。
(4)保持压强不变,充入N2使容器的体积增大,其反应速率____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把6mol铜粉投入含8mol硝酸和2mol硫酸的稀溶液中,则标准状况下放出的气体的物质的量为( )
A. 5mol B. 4mol C. 3mol D. 2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应都有水参加,其中属于氧化还原反应,而水既不做氧化剂,又不做还原剂的是( )
A.2F2+2H2O=4HF+O2↑
B.2Na+2H2O=2NaOH+H2↑
C.C12+H2O=HC1O+HC1
D.C+H2O ![]() CO+H2
CO+H2
查看答案和解析>>
科目: 来源: 题型:
【题目】“神舟九号”回收伞不同于普通的航空伞,它是采用强力高、重量轻、缓冲性好的特制涤纶材料制成的,伞撑开的面积有1200平方米.下列关于涤纶材料的说法中不正确的是( )
A.涤纶属于高分子材料
B.“神舟九号”回收伞用的这种涤纶材料耐高温
C.涤纶属于合成橡胶
D.合成涤纶的反应属于聚合反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关有机化合物的说法正确的是( )
A.用水可以区分乙酸乙酯和苯
B.有机物分子中都存在碳碳单键
C.聚乙烯属于高分子化合物
D.乙醇、油脂、淀粉是人们必需的营养物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 增进健康应以平衡膳食为主,保健食品为辅
B. 膳食中的钙与磷、蛋白质配合,容易被人体吸收
C. 多晒太阳有利于钙的吸收
D. 钙、铁同补相得益彰
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为_______。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中配体分子的立体构型是_______,其中心原子的杂化轨道类型为_________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K, 沸点为376K,则Ni(CO)4固体属于_____晶体,其中存在的化学键类型为_________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO (填 “>”“<” 或“=”),原因是___________。
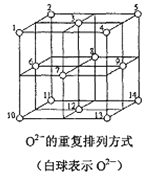
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_____pm。(写出计算表达式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com