
科目: 来源: 题型:
【题目】硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有____________。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是____________。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是____________________,弊是________________________。聚合硫酸铁溶液中SO42与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42与Fe3+物质的量之比。
(4)测定时所需的试剂____________。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定____________和____________的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作____________(按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
查看答案和解析>>
科目: 来源: 题型:
【题目】根据电离常数(用Kb表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | HClO |
电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)氢氟酸的电离方程式为________________________。
(2)同浓度的HF、H2CO3、HClO三种溶液中,pH最大的是_____(写化学式)。
(3)同浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。(填字母)
A.c(H+) B.c(H+)·c(OH—) C.c(H+)/c(HF) D.c(OH-)/c(H+)
(4)25℃时,现有物质的量浓度均为0.1mol/L的四种溶液: ① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。(用序号表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾广泛用作氧化剂。现有一个氧化还原反应的体系中共有KMnO4、MnSO4、H2O、Fe2(SO4)3、
FeSO4、H2SO4、K2SO4七种物质。
Ⅰ.写出一个包含上述七种物质的氧化还原反应方程式(需要配平):____________。
Ⅱ.某研究性学习小组根据上述反应设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol/L,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(1)此原电池的正极是石墨__________(填“a”或“b”),发生________反应。
(2)电池工作时,盐桥中的SO42-移向________(填“甲”或“乙”)烧杯。
(3)乙烧杯中的电极反应式分别为__________________。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】某餐馆有一款小吃——牛肉饼,其部分原料如下:
①牛肉 ②面粉 ③食盐 ④香油
(1)富含油脂的是________(填序号,下同)。
(2)富含蛋白质的是________。
(3)富含淀粉的是________。
(4)属于调味剂的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用乙醇和浓硫酸制取乙烯,其反应式为CH3CH2OH![]() CH2=CH2↑+H2O实验时常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
CH2=CH2↑+H2O实验时常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:

I、II、III、IV装置可以盛放的试剂有:
A、品红溶液 B、NaOH溶液
C、浓硫酸 D、酸性KMnO4溶液(试剂可以重复使用)
(1)I、II、III、IV装置中所盛的试剂分别为:_________、_________、_________、_________(填序号)
(2)使用装置II的目的是_________________。
(3)确定含有乙烯的现象是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空
(1)烷烃A在同温、同压下蒸气的密度是H2的43倍,其分子式为___________。
(2)0.1 mol 烷烃E完全燃烧,消耗标准状况下的O211.2 L,其分子式为___________。
(3)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为____________。
(4)某有机物的结构表达式为![]() ,其名称是_______________。
,其名称是_______________。
(5)萘的结构式为![]() ,其分子式为 ,它的二氯代物又有 种。
,其分子式为 ,它的二氯代物又有 种。
(6)立方烷![]() 其分子式为 ,它的六氯代物有 种。
其分子式为 ,它的六氯代物有 种。
查看答案和解析>>
科目: 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题。
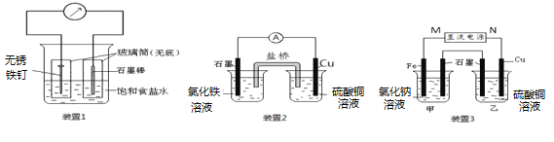
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为_________________。
(2)装置2中的石墨是极________(填“正”或“负”),该装置发生的总反应的离子方程式为________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为极____________(填“正”或“负”),甲烧杯中铁电极的电极反应为__________。
② 乙烧杯中电解反应的化学方程式为___________________________。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为___________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com