
科目: 来源: 题型:
【题目】下列说法正确的是
A.煤的干馏和石油的分馏都是化学变化
B.漂白粉、水玻璃和碱石灰都是混合物
C.纯碱、明矾和干冰都是电解质
D.乙酸乙酯中混有乙酸,可加入饱和氢氧化钠溶液,振荡、静置后分液
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列反应的热化学方程式为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
A. -488.3 kJ·mol-1 B. -191 kJ·mol-1
C. -476.8 kJ·mol-1 D. -1 549.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,在容积为2L的3个恒容密闭容器中发生反应:3A(g)+B(g)![]() xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
还到平衡的时间/min | 5 | 8 | |
A的浓度/mol L-1 | cl | c2 | O |
C的体积分数/% | ω1 | ω3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是
A. 若x<4,则2c1<c2
B. 若x=4,则ω1=ω3
C. 无论x的值是多少,均有2ρ1=ρ2内
D. 容器甲中反应从开始到平衡的平均反应速率可能为v(A)=0.3mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,当加入80 g SO2气体发生催化氧化反应生成SO3气体时,放出热量98.3 kJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是( )
A. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=-98.3 kJ·mol-1
SO3(g) ΔH=-98.3 kJ·mol-1
B. 2SO2(g)+O2(g)![]() 2SO3(l) ΔH=-196.6 kJ·mol-1
2SO3(l) ΔH=-196.6 kJ·mol-1
C. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=-78.64 kJ·mol-1
SO3(g) ΔH=-78.64 kJ·mol-1
D. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol-1
2SO3(g) ΔH=196.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法。某同学用下表所示形式对所学知识进行分类,其中甲与乙关系正确的是( )
选项 | 甲 | 乙 |
A. | 电解质 | BaSO4、NaHSO4、SO3 |
B. | 弱电解质的电离 | 均分步电离 |
C. | 化学平衡影响因素 | 温度、压强、浓度、催化剂等 |
D. | 化学电源 | 一次电池、二次电池、燃料电池等 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求填空:
(1)用化学符号填空:①氯化亚铁中的阳离子;②标出碳酸钡中钡元素的化合价;③三个钙原子 .
(2)①SO3中“3”的含义:;②Mg2+中“2”的含义: .
(3)“候氏制碱法”中的创始人 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在一体积可变的密闭容器中发生反应:2M(g)+N(s)![]() 3P(g) △H<0。下列有关说法正确的是
3P(g) △H<0。下列有关说法正确的是
A. 该反应在常温下不能自发进行
B. 达到平衡后,再加入一定量的N,平衡正向移动
C. 达到平衡后,再增大容器体积,反应速率加快
D. 达到平衡后,再升高温度,平衡逆向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
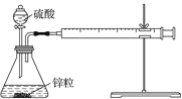
A. 可以通过测定锌粒减少质量来测定反应速率
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol·L-1·s-1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应速率为0.01 mol·L-1·s-1
D. 用H2来表示10 s内该反应的速率为0. 000 2 mol·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列推断正确的是
A. pH=6.5的溶液一定显酸性
B. 0.1mol L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol L-1
C. 常温下,等体积的0.2 mol L-1的盐酸与0.2 mol L-1的氢氧化钡溶液混合,所得溶液的pH=13
D. 常温下,某溶液中水电离出的c(OH-)=l×10-12 mol L-1,该溶液pH 一定等于2
查看答案和解析>>
科目: 来源: 题型:
【题目】A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答:
(1)物质B、E和F的化学式为B、E、F;
(2)反应①的化学方程式为: , 其反应类型为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com