
科目: 来源: 题型:
【题目】钛合金被誉为二十一世纪的金属,具有广泛的用途。金属钛可用下列方法提炼:
①TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
对上述两个反应,下列有关叙述正确的是
A. 反应①中碳元素被还原 B. 反应②中钛元素被氧化
C. 反应①中Cl2是还原剂 D. 反应②中TiCl4是氧化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A.H2SO4的摩尔质量是98
B.2 mol NO中含2 mol氮和2 molO
C.等质量的O2和O3中所含氧原子个数相同
D.1 mol O2 的体积是22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( ) 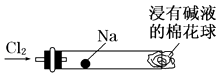
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.发生的反应为2Na+Cl2═2NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】将5.10g镁铝合金加入120mL4.0mol·L-1的盐酸中,待合金完全溶解后,得到溶液X。下列说法一定正确的是
A. 合金完全溶解后产生的H2的物质的量为0.24mol
B. 合金中的镁与铝的物质的量之比小于1
C. 若向溶液X中加入270mL2.0mol·L-1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D. 若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质量大于8.50g.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法正确的是
MnCl2+Cl2↑+2H2O。实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法正确的是
A. 若产物为NaClO、NaCl,则吸收后的溶液中n(ClO-)=n(Cl-)
B. 若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
C. 若产物为NaClO、NaClO3、NaCl,则由吸收后的溶液中n(Cl-)和n(ClO-)可计算吸收的n(Cl2)
D. 若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl2)是一种重要的催化剂。实验室按如下装置和方案制备氯化亚铜(已知:Cu2++6Cl―+ Cu=2CuCl32-)

实验步骤:
①加热至50℃,铜丝表面产生无色气泡,液面上方有红棕色气体产生;
②通入并调节氧气的量维持三颈瓶内压强不变。停止加热,反应继续进行,越来越剧烈;
③反应停止后冷却至室温,待气囊变瘪。瓶内红棕色气体消失时关闭K;
④将液体(含CuCl32-等)转移至烧杯中用蒸馏水稀释,产生白色沉淀,过滤得氯化亚铜粗品和滤液;
⑤氯化亚铜粗品经洗涤、烘干,得到氯化亚铜。
回答下列问题:
(1)写出步骤①中铜丝表面产生无色气泡的化学方程式_________。
(2)步骤②中停止加热后,反应越来越剧烈的原因是_______。
(3)步骤③中瓶内红棕色气体消失的原因是_______。(结合化学方程式回答)
(4)步骤④中产生白色沉淀的离子方程式是_________。
(5)步骤④所得滤液经浓缩后可返回至三颈瓶继续使用,此时需向三颈瓶内补充的物质有____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学欲配制480mL物质的量浓度为0.1mol/L的CuSO4溶液.
(1)完成该实验用到的仪器主要有:托盘天平、胶头滴管、 , 烧杯、玻璃棒、药匙.
(2)如果用CuSO4固体来配制,应该称量固体的质量为 .
(3)下列操作对溶液的浓度有何影响?用“偏大”“偏小”或“无影响”填空. ①配制的过程中有少量的液体溅出烧杯.
②使用前容量瓶用蒸馏水洗涤,且没有干燥.
③定容时俯视液面. .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com