
科目: 来源: 题型:
【题目】用惰性电极电解AgNO3溶液一段时间后,下列有关说法正确的是( )
A. 阳极质量增加
B. 向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况
C. 电解过程中溶液的pH不断升高
D. 电解后两极产生的气体体积比为2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一套实验室制取气体的装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是
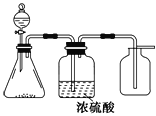
A.制取NO气体 B.制取二氧化碳气体
C.制取氢气 D.制取氨气
查看答案和解析>>
科目: 来源: 题型:
【题目】蔬菜、水果中富含纤维素,纤维素被食入人体后的作用是( )
A. 为人体内的化学反应提供原料
B. 为维持人体生命活动提供能量
C. 加强胃肠蠕动,具有通便功能
D. 人体中没有水解纤维素的酶,所以纤维素在人体中不能水解
查看答案和解析>>
科目: 来源: 题型:
【题目】谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种不溶于水、酸和乙醇的固体,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装罝如下图所示:
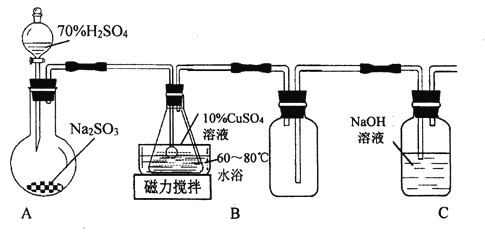
(1)装置A在常温下制取SO2时,用70%硫酸而不用稀硫酸和98%浓硫酸,其原因是________。
(2)装置B中发生反应的离子方程式为_________。
(3)装置C的作用是__________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。检验己洗涤完全的方法是________________。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O) 的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,边搅拌边向其中滴入______溶液,加入适最纯净的________调节3.2<pH<4.2,静置,过滤,将滤液水浴加热蒸发浓缩至表面出现晶膜,冷却结晶,过滤,用95% 酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2 (5.8, 8.8); Cu(OH)2 (4.2, 6.7); Fe(OH)3 (1.1,3.2)]
查看答案和解析>>
科目: 来源: 题型:
【题目】CoCl2· 6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、 Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2· 6H2O的工艺流程如下:
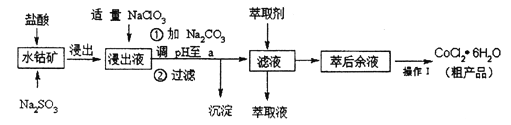
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(金属离子浓度为0.01 mol/L):
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co (OH) 2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2· 6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中主要发生的离子反应方程式:______________。
(2)若不慎向“浸出液”中加过量NaC1O3时,可能会生成的有害气体是_______(填化学式)。
(3)萃取剂对金属离子的萃取率与pH的关系如图,向“滤液”中加入萃取剂的目的是_______,其使用的最佳pH范围是 ________(选填下列字母)。

A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(4) “操作1”是________。制得的CoCl2· 6H2O需减压烘干的原因是__________。
(5)为测定粗产品中CoCl2· 6H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2· 6H2O的质量分数大于100%,其原因可能是___________________。(答一条即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物在反应中,常有原子间的共价键全部或部分断裂,如C—H、C—C、C=C、C—O、C=O等。下列各反应中,反应物分子中断裂键的排列,正确的组合是
化学反应 | 乙醇酯化 | 乙醇与钠 | 乙醛氧化 | 乙醛加氢 |
A | O—H | C—H | C—H | C—O |
B | O—H | O—H | C—H | C=O |
C | C—O | C—O | C—H | C=O |
D | C—O | C—H | C—C | C—O |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化合物K2S2O8、CrO5中的硫与铬元素的化合价均为+6,则K2S2O8、CrO5中含有的过氧键(—O—O—)个数分别为( )
A.1个,1个B.1个,2个
C.2个,1个D.2个,2个
查看答案和解析>>
科目: 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨,从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工作流程如下:

(1)铅蓄电池放电时,PbO2作_______极。
(2)过程 I ,己知:PbSO4、PbCO3 的溶解度(20℃)见图 1; Na2SO4、Na2CO3的 溶解度见图2。

①根据图1写出过程I的离子方程式:_____________。
②生产过程中的温度应保持在40℃。若温度降低,PbSO4的转化速率下降。根据图2,解释原因:
i.温度降低,反应速率降低;
ii._______________(请你提出一种合理解释)。
(3)过程 II,发生反应 2PbO2 + H2C2O4=2PbO + H2O2 + 2CO2↑。PbO与 Al2O3性质相似,PbO与氢氧化钠溶液反应的离子方程式是________________。
(4)过程Ⅲ,将PbO粗品溶解在H2SO4和NaCl的混合溶液中,得到含Na2PbCl4的电解液。电解Na2PbCl4溶液,生成Pb,如下图。

①阴极的电极反应式是____________。
②电解一段时间后,Na2PbCl4浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
(1)①将钠、钾、镁、铝各1mol分别投入到足量的0.1molL﹣1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式 .
②将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH的碱性大于NH3H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: .
(2)利用如图装置可以验证非金属性的变化规律. 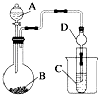
③实验室中提供药品Na2S,MnO2、浓盐酸、KMnO4 , 若要证明非金属性Cl>S;装置A,B,C中所装药品分别为 , 装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 .
④若要证明非金属性:C>Si,则A中加、B中加Na2CO3、C中加Na2SiO3 , 则观察装置C中的实验现象为有白色沉淀生成.离子方程式为 . (假设所通气体是过量的).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com