
科目: 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:

称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3 、FeO和SO2气体,实验后取d中溶液的1/5置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.10mL,末读数如图2所示.完成下列填空:
(1)装置c的作用是____________________________。
(2)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(3)滴定时,标准碘溶液所耗体积为_____mL;用化学方程式表示滴定的原理:________________________________________。
(4)计算该黄铜矿的纯度___________________。
(5)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3 、FeO、SiO2、Al2O3)可制备Fe2O3.
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所选试剂为_________;证明炉渣中含有FeO的实验现象为:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液980 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是
A. 950 mL 111.2 g B. 500 mL 117.0g
C. 1000 mL 117.0 g D. 1000 mL 114.7 g
查看答案和解析>>
科目: 来源: 题型:
【题目】I.(1)25℃、101kPa时,使1.0 g乙烯与足量的氧气反应,生成CO2和液态H2O并放出50 KJ的热量,表示乙烯燃烧热的热化学方程式为_________________________。
(2)比较下列热化学方程式中ΔH的大小关系。
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (l) ΔH1
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (g) ΔH2
则ΔH1________ΔH2
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C (s,石墨) + O2 (g) = CO2 (g) ΔH1
2H2 (g) + O2 (g ) =2H2O (l) ΔH2
2C2H2 (g) + 5 O2 (g ) =4 CO2 (g)+2 H2O (1) ΔH3
则2C (s,石墨)+ H2 (g)= C2H2 (g) 反应的ΔH的表达式为:ΔH =_____。
II. 草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+ 5H2C2O4+ 6H+= 2 Mn2++ 10CO2↑ + 8H2O。现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
I | 2 mL | 20 | / |
II | 2 mL | 20 | MnSO4固体 |
III | 2 mL | 30 | / |
IV | 1 mL | 20 | 1 mL蒸馏水 |
(4)如果研究催化剂对化学反应速率的影响,使用实验_______和____ (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验_____和______。
(5)对比实验I和IV,可以研究_________________对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 _______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液与20mL 1 molL—1 NaNO3溶液中NO3- 物质的量浓度相等的
A. 10 mL 1 molL-1 Mg(NO3)2溶液 B. 5 mL 1molL-1 Al(NO3)3溶液
C. 10 mL 0.5 molL-1 Ag NO3溶液 D. 10 mL 0.5molL-1 Cu(NO3)2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】如表列出了A~R九种元素在周期表的位置:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
(1)写出R单质分子的电子式 .
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是(填化学式).
(3)A,B,C三种元素的阳离子按离子半径由大到小的顺序排列为 . (用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式 .
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是 , 它位于元素周期表中位置:
查看答案和解析>>
科目: 来源: 题型:
【题目】如图列出了①~⑨九种元素在周期表中的位置: 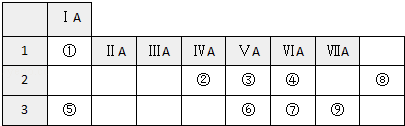
请按要求回答下列问题.
(1)元素⑧的名称是 , 元素⑧在周期表中所处位置 . 元素④的氢化物沸点高于⑦的氢化物沸点,原因是 .
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是(写氢化物的化学式).
(3)元素②④形成原子个数比为1:2的化合物的电子式是 .
(4)元素②形成的一类氢化物称为烷烃,通式是 , 其中(填分子式)有两种同分异构体,结构简式分别是 .
(5)用电子式表示⑤与⑦形成化合物的过程 .
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
在以上制备甲醇的两个反应中:反应I优于反应II,原因为_____________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)ΔH1=-Q1 kJ/mol
②2CO(g)+ O2(g)=2CO2(g) ΔH2=-Q2 kJ/mol
③H2O(g)=H2O(l) ΔH3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:_______。
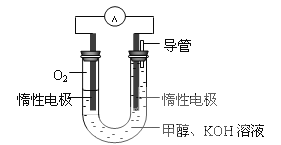
(3)某同学依据甲醇燃烧的反应原理,设计如下图所示的电池装置,工作一段时间后,测得溶液的pH将___________填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:________________。
Ⅱ 325K、起始压强为100kPa时,在体积为2L的密闭容器中充入4.6 g NO2 ,发生反应:2NO2(g)![]() N2O4(g)。
N2O4(g)。
(1)NO2与N2O4的消耗速率与其浓度的关系如图所示,图中交点A表示该反应所处的状态为________;

A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
(2)能够说明上述反应已经达到平衡状态的有____________;
a.NO2和N2 O4的物质的量相等
b.体系颜色不在变化
c.容器内混合气体的密度不再改变
d.容器内气体压强不发生变化
(3)若达到平衡后容器内混合气体的平均相对分子质量为57.5。平衡时NO2的转化率为_______,此条件下的平衡常数K=________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2 (g) + H2 (g)![]() CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
T/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________________。
(2)该可逆反应的正反应为_____________反应(选填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度满足关系式:3c(CO2)·c(H2) = 5c(CO)·c(H2O),该温度为______。
(4)若830℃时,该容器中的反应已达到化学平衡状态:
①在其他条件不变时,再向容器中充入2 mol CO2,达到新平衡后,与原平衡相比,H2的转化率_____(填“增大”“不变”或“减小”)。
②在其他条件不变时,再向容器中充入1 mol CO、2 mol H2O,达到新平衡后,其化学平衡常数K__1.0(选填“>”“<”或“=”)。
(5)若1200℃时,某个时刻,该密闭容器中的CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,此时上述反应________(填“正向” “逆向”或“处于平衡状态”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g) 在1L的密闭容器中进行,30s后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(g)+ 6H2O(g) 在1L的密闭容器中进行,30s后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. v(NH3)= 0.1 mol·L1·s-1 B. v(O2)= 0.01 mol·L1·s-1
C. v(NO)= 0.01 mol·L1·s-1 D. v(H2O)= 0.045 mol·L1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com