
科目: 来源: 题型:
【题目】将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液.只用一种试剂就能加以区别,这种试剂是
A. KSCN B. BaCl2 C. NaOH D. HCI
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M是一种食品香料,可以C4H10为原料通过如下路线合成:
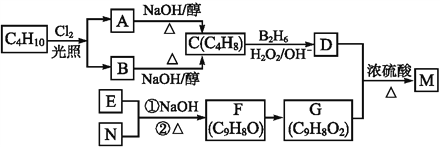
已知:①R—CH![]() CH2
CH2![]() R—CH2CH2OH
R—CH2CH2OH
②RCH2CHO+R'CH2CHO![]()
![]()
![]()
![]()
③F分子中的碳链上没有支链;E为芳香族化合物且E、N都能发生银镜反应。
请回答下列问题:
(1)A、B均为一氯代烃,写出其中一种的名称(系统命名)____;M中的官能团名称为______。
(2)写出下列反应的反应类型:F→G________,D+G![]() M________。
M________。
(3)F与新制Cu(OH)2/NaOH(aq)反应的化学方程式为____________________。
(4)M的结构简式为____________;E的核磁共振氢谱有____种峰。
(5)与G具有相同官能团的G的芳香类同分异构体有____种,请写出其中一种的结构简式:________________。
(6)参照上述合成路线,以苯乙烯(![]() )和乙醛为原料(无机试剂任选),设计制备
)和乙醛为原料(无机试剂任选),设计制备
![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“建设大美运城”要求人们出行和化工生产做到“绿色、低碳”。下列做法不可取的是
A.推广共享公共工具B.大力开发化石能源
C.推广使用新型能源D.推广使用电子货币
查看答案和解析>>
科目: 来源: 题型:
【题目】将少量金属钠放入盛有CuSO4溶液的烧杯中,烧杯中发生的反应是
①2Na+CuSO4=Na2SO4+Cu
②Cu+2H2O=Cu(OH)2↓+H2↑
③2Na+2H2O=2NaOH+H2↑
④2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
A.① B.①② C.③④ D.①③
查看答案和解析>>
科目: 来源: 题型:
【题目】A,B,C,D,E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质. 
请填空:
(1)形成单质A的原子的结构示意图为 , 它的最高化合价为 .
(2)B的化学式(分子式)为 , B和碳反应生成A和E的化学方程式是 .
(3)C的化学式(分子式)为 , D的化学式(分子式)为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):

已知:2NO+CaO2 =Ca(NO2)2;2NO2+CaO2=Ca(NO3)2。
请回答下列问题:
(1)将分液漏斗中的稀硝酸滴入三颈烧瓶中的操作为______________。
(2)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因为_________________。
(3)装置D中的仪器名称为_______________。装置B所加试剂为_______________。
(4)装罝F中,酸性K2Cr2O7溶液可将剩余的NO氧化为NO3-,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式为_________________。
(5)已知:Ca(NO2)2溶液遇酸会产生NO气体。设计实验证明装置E中有亚硝酸钙生成:____________。
(6)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化空气,又能获得应用广泛的 Ca(NO2)2,反应原理为Ca(OH)2 + NO+NO2=Ca(NO2)2 + H2O。
①若n(NO):n(NO2)>l:l,则会导致______________________________。
②若n(NO):n(NO2)<1:1,则会导致________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列观察目的与实验操作-致的是
观察目的 | 实验操作 | |
A | 钠的密度比水小 | 将-小块钠放入盛水的烧杯中 |
B | 钠有强还原性 | 将钠放置在煤油中 |
C | 钠有较小的硬度 | 将钠放在坩埚中加热 |
D | 钠的熔点较低 | 用小刀切开金属钠 |
A.AB.BC.CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol/L,则此时v(正)<v(逆)
C. 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D. 恒温时将气体体积缩小到原来的一半,达到新平衡时CO浓度将要减小
查看答案和解析>>
科目: 来源: 题型:
【题目】铁的化合物在工业上有重要的应用.
(1)FeCl3净水的原理是(用离子方程式表示)_________________.FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)________________.
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2废液得到FeCl3.
①若酸性FeCl2废液中c(Fe2+)=2.0×10﹣2molL﹣1,c(Fe3+)=1.0×10﹣3molL﹣1,c(Cl﹣)=5.3×10﹣2molL﹣1,则该溶液的PH约为_____.
②完成NaClO3 氧化FeCl2 的离子方程式:
ClO3﹣ +___Fe2+ +___ ____= __Cl﹣ + ___Fe3++ __ ____.
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐热稳定性差,工业上用湿法制备K2FeO4的流程如图1所示:反应③加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明__________________________.某温度下,将Cl2通入NaOH溶液中,反应后得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO﹣与ClO3﹣离子的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为_____.
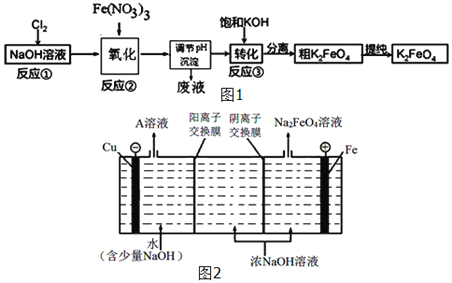
(4)工业上还可用通过电解浓NaOH溶液来制备Na2FeO4,其工作原理如图2所示:阳极的电极反应式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将固体NH4Br置于密闭容器中,在某温度下,发生下列可逆反应:NH4Br(s) ![]() NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g) ![]() Br2(g)+H2(g),2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用
Br2(g)+H2(g),2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用![]() (NH3)表示,下列反应速率正确的是
(NH3)表示,下列反应速率正确的是
A.0.5mol/(L·min) B.2.5 mol/(L·min)
C.2 mol/(L·min) D.5 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com