
科目: 来源: 题型:
【题目】(1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.
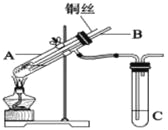
A中装置体现了浓硫酸的哪些性质?______;
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在______(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过______、______、过滤、洗涤、干燥,即可得到产品CuSO45H2O晶体,干燥时需要控制温度小于100℃,若温度过高,则会导致______.
(3)探究小组用滴定法测定某胆矾晶体中CuSO4的含量.取ag样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用c molL﹣1的EDTA(H2Y2﹣)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2﹣=CuY2﹣+2H+.
①写出计算CuSO4质量分数的计算式ω=______;
②下列操作会导致CuSO4含量的测定结果偏低的是______.
a.用样品溶液润洗锥形瓶
b.滴定终点时俯视读数
c.滴定终点时滴定管尖嘴中有气泡
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+3HSO3﹣=3SO42﹣+Cl﹣+3H+ , 已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3﹣在单位时间内的物质的量浓度的变化来表示该反应速率的速率﹣时间图象.下列说法不正确的是( ) 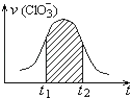
A.反应开始时速率增大可能是c(H+)增大引起的
B.纵坐标为v(H+)的速率﹣时间曲线与图中曲线不能完全重合
C.后期反应速率下降的主要原因是反应物浓度减小
D.图中阴影部分“面积”为t1至t2时间内的ClO3﹣的物质的量的减小值
查看答案和解析>>
科目: 来源: 题型:
【题目】为比较不同的催化剂对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.下列叙述中不正确的是( ) 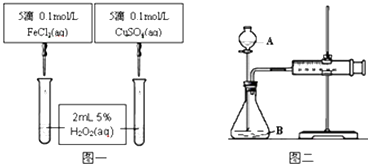
A.图1实验可通过观察产生气泡快慢来比较反应速率的大小
B.若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图2装置可测定反应产生的气体体积
D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目: 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:
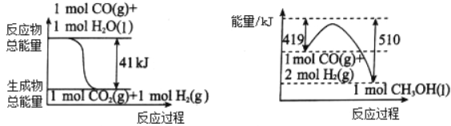
则CO2与H2反应生成CH3OH的热化学方程式为_____________________
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1>0
CO(g)+3H2(g) △H1>0
Ⅱ.CO(g)+2H2(g)![]() CH3OH(g) △H2<0
CH3OH(g) △H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。
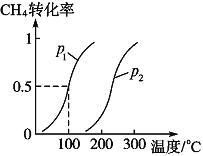
①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为________;
②图中的p1_______p2(填“<”、“>”或“=”),判断的理由是________________________。
③若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是_________(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol·L﹣1)变化如下表所示:
2min | 5min | 10min | |
CO | 0.07 | 0.06 | 0.05 |
H2 | 0.14 | 0.12 | 0.20 |
CH3OH | 0.03 | 0.04 | 0.05 |
若5min时只改变了某一条件,则所改变的条件是_____________;10min时测得各物质浓度如表,10min时v正_______v逆(填“<”、“>”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。
(1)在一定温度下,将足量SO2气体通入甲酸(HCOOH)和NaOH混合溶液中,即有保险粉生成同时生成一种气体。该反应的化学方程式为_________________________。
(2)保险粉可用于除去废水中的重铬酸根离子(Cr2O72﹣被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,则每消耗0.2mol保险粉,理论上可除去Cr2O72﹣的物质的量为__________mol
(3)Na2S2O4溶液在空气中易被氧化,某课题小组测定0.050mol·L﹣1Na2S2O4溶液在空气pH变化如下图1;
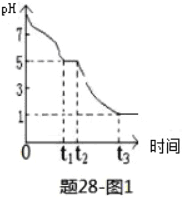

①0-t1段主要生成HSO3﹣,根据pH变化图,推测0-t1发生反应的离子方程式为_______________;
②t3时溶液中主要阴离子是_________,t2-t3阶段pH变小的主要原因是______________________。
③若t1时溶液中Na2S2O4全部被氧化成NaHSO3,此时溶液中c(SO32﹣)—c(H2SO3)=___mol·L﹣1(填准确值,不考虑溶液体积变化)。
(4)利用图2所示装置(电极均为惰性电极)也可使NaHSO3转化为Na2S2O4,并获得较浓的硫酸。
①a为电源的________(填“正极”或“负极”);
②阴极的电极反应式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾可以净水是因为( )
A. 明矾在水中能电离出硫酸根离子
B. 明矾含有钾离子和铝离子两种阳离子
C. 明矾溶于水后能生成氢氧化铝胶体
D. 明矾能与碱反应生成氢氧化铝沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产生活密切相关。下列叙述错误的是( )
A.有机玻璃的主要成分是硅酸盐和二氧化硅
B.硫酸亚铁与维生素C混用有利于铁元素吸收
C.汗水浸湿的衣服晾干后的白色斑迹主要是氯化钠
D.通过石油的裂解可以得到乙烯、丙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com