
【题目】氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+3HSO3﹣=3SO42﹣+Cl﹣+3H+ , 已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3﹣在单位时间内的物质的量浓度的变化来表示该反应速率的速率﹣时间图象.下列说法不正确的是( ) 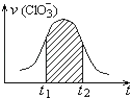
A.反应开始时速率增大可能是c(H+)增大引起的
B.纵坐标为v(H+)的速率﹣时间曲线与图中曲线不能完全重合
C.后期反应速率下降的主要原因是反应物浓度减小
D.图中阴影部分“面积”为t1至t2时间内的ClO3﹣的物质的量的减小值
【答案】D
【解析】解:A.由方程式:ClO3﹣+HSO3﹣﹣SO42﹣+Cl﹣+H+可知:反应开始时随着反应的进行,c(H+)不断增大,反应的速率加快由题目信息可知反应的速率随c(H+)的增大而加快,故A正确;
B.该方程式为ClO3﹣+3HSO3﹣=3SO42﹣+Cl﹣+3H+ , v(ClO3﹣):v(H+)=1:3,纵坐标为v(H+)的v﹣t曲线与图中曲线不重合,故B正确;
C.随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故C正确;
D.由ClO3﹣+3HSO3﹣=3SO42﹣+Cl﹣+3H+ , △n(Cl﹣):△n(ClO3﹣)=1:1,所以图中阴影部分“面积”可以表示t1﹣t2时间为n(Cl﹣)增加或者是ClO3﹣浓度的减小,故D错误;
故选D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 , 该反应为反应(填“放热”或“吸热”).
(2)t1=s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度) .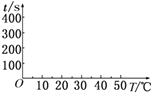
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是 .
(4)t1(填“>”或“<”)t4 , 原因是 .
t2t3(填“>”或“<”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A+、B﹣、C2﹣、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是、B元素是、C元素是(用元素符号表示).
(2)D是由两种元素组成的双原子分子,用电子式表示其形成过程 .
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 , 其与水反应的化学方程式为 .
(4)F分子中含有4个原子,其电子式是或 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解池的叙述不正确的是( )
A.与电源正极相连的是电解池的阴极
B.与电源负极相连的是电解池的阴极
C.在电解池的阳极发生的是氧化反应
D.若用铁做阴极,则铁不会被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关。下列叙述错误的是( )
A.有机玻璃的主要成分是硅酸盐和二氧化硅
B.硫酸亚铁与维生素C混用有利于铁元素吸收
C.汗水浸湿的衣服晾干后的白色斑迹主要是氯化钠
D.通过石油的裂解可以得到乙烯、丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的海水综合利用的工业流程图,判断下列说法正确的是

已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 在过程④、⑥反应中每氧化0.2 mol Br-需消耗2. 24 L Cl2
D. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com