
科目: 来源: 题型:
【题目】纳米铜有很多奇特的性质,比如超塑延展性,在室温下可拉长50多倍而不出现裂纹,铜纳米晶体的这种机械特性为制造常温下的弹性物质开辟了光明前景。此外,纳米铜还用作热氨发生器、凝胶推进剂、燃烧活性剂、催化剂、水清洁吸附剂、烧结活性剂等。纳米铜比普通铜更容易与氧气发生反应,常温下在空气中可以自燃。以下是纳米铜的一种制备工艺,用于制备50~100nm的铜粉。

已知:油酸(C17H33COOH)难溶于水,可溶于乙醇。
步骤①中发生的反应为:2C17H33COOH +Cu2+![]() Cu(C17H33COO)2 +2H+
Cu(C17H33COO)2 +2H+
步骤②中发生的反应为:2Cu(C17H33COO)2 + C6H12O6+5OH- =Cu2O+C5H11COO-+4C17H33COO-
回答下列问题:
(1)将纳米铜粉加人燕馏水中,搅拌均匀后,得到的分散系类型是_________
(2)步骤①中调节pH5.5~6.0时,萃取率最高,pH不能过大也不能过小,若过小则______,若过大则__。
(3)NaH2PO2中P的化合价是_______,在步骤③中被氧化得到的产物是NaH2PO3,该反应的化学方程式是_____。已知NaH2PO2为正盐且溶液呈碱性.NaH2PO2溶液呈碱性原因用离子方程式可表示为_。
(4)用乙醇清洗产物的目的是__________。
(5)真空干燥产品的原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C (g),各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
2C (g),各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |

下列说法正确的是
A. 10min内甲容器中反应的平均速率v(A)=0.025mol/(Lmin)
B. 由图可知:T1<T2,且该反应为吸热反应
C. x=1,若平衡时保持温度不变,改变容器体积平衡移动
D. T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 天然气是不可再生能源
B. 用水煤气可合成液态碳氢化合物和含氧有机物
C. 煤的液化属于物理变化
D. 火棉是含氮量高的硝化纤维
查看答案和解析>>
科目: 来源: 题型:
【题目】今年6月20日,2016年全球最受关注的十大化学成果发布,其中有两项与空气中的二氧化碳处理利用技术有关。其一为美国伊利诺斯大学芝加哥分校和阿贡国家实验室科学家联合设计的新型太阳能电池,可直接把大气中的二氧化碳转化为合成气(CO和H2)该设计同时具有环保和经济价值,不仅可以减缓二氧化碳的排放,而且可以生成重要的化工原料。
(1)下列材料也可以用于制造太阳能电池的是____________。
A.Ag2O B.Fe3O4 C.Si D.SiO2
(2)下图装置可实现二氧化碳到一氧化碳的转化

①电源的正极为______(“A”或“B")。
②阴极发生反应的电极方程式为:___________.
(3)CO 和H2可用于合成甲醇。
①已知CO、H2、CH3OH(1)的燃烧热为283.0kJ/mol、285. 8kJ/mol、726.5kJ/mol,写出 由CO和H2制备CH3OH(1)的热化学方程式__________。
②在398K,1L的恒容容器中充入0.1molCO和0.2molH2,发生反应CO(g)+2H2(g)=CH3OH(g),反应过程中气体的压强如下表所示(atm为标准大气压)。
时间(min) | 0 | 1 | 5 | 10 | 30 | 50 |
压强(atm) | 10 | 9.3 | 8.0 | 7.2 | 4 | 4 |
5min内该反应的平均速率用CO可表示为______,该温度下的平衡常数是_____。达到平衡后,向该容器中通入0.05mol的气态CH3OH,再次达到平衡时,CH3OH的体积分数比原平衡时_____( 填“大”或“小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。
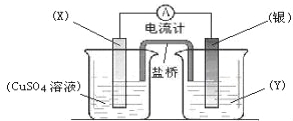
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于铁和铁合金的有关说法错误的是
A. 工业上用一氧化碳将铁矿石中的铁还原出来
B. 不锈钢抗腐蚀性能好,长期使用绝对不会生锈
C. 制造铁轨、船舶、桥梁的碳素钢是铁和碳的合金
D. 使用铁锅烧饭菜能为人体提供微量的铁元素
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:4P(红磷, s)+5O2(g)==2P2O5(s)放热a kJ;4P(白磷, s)+5O2(g)==2P2O5(s)放热b kJ
常温下红磷比白磷稳定,则a与b的大小关系是
A. a<b B. a=b C. a>b D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶被中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O![]() H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com