
科目: 来源: 题型:
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)利用CO生产乙醇: 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)ΔH1
CH3CH2OH(g)+H2O(g)ΔH1
又已知:H2O(l)=H2O(g)ΔH2 CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH3
CO2(g)+H2(g)ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)。下列措施中能够同时满足增大反应速率和提高CO转化率的是____(填字母)。
CH3OCH3(g)+H2O(g)。下列措施中能够同时满足增大反应速率和提高CO转化率的是____(填字母)。
A.使用高效催化剂 B.降低反应温度
C. 增大体系压强 D.不断将CH3OCH3从反应混合物中分离出来
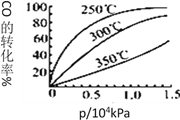
(3)采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+ 2H2(g)![]() CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①合成甲醇的反应为_______(填 “放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_____________。
③达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_________L。
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示,实际生产时条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是
A. 实验室采用排饱和食盐水的方法收集氯气Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. 工业上合成氨反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0 选择500 ℃
2NH3(g) △H<0 选择500 ℃
C. H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D. SO2氧化成SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】在某透明的强酸性溶液中,能大量共存的离子组是 ( )
A. Na+、NO3-、Fe2+、Cl-
B. Na+、SO42-、Ba2+、NO3-
C. MnO4-、K+、SO42-、Na+
D. K+、SO42-、HCO3-、Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的.在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是( )
A.①③②
B.②③①
C.③①②
D.②①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com