
科目: 来源: 题型:
【题目】以氧化铝为原料制取氢氧化铝,最好的方法是( )
A.将氧化铝溶于水
B.将氧化铝先溶于盐酸中,之后滴加氨水
C.将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液
D.将氧化铝溶于氢氧化钾溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1) 某浓度的氨水中存在平衡:NH3·H2O ![]() NH4+ + OH-,如想增大NH4+的浓度而不增大OH-的浓度,可采取的措施是___________填字母)。
NH4+ + OH-,如想增大NH4+的浓度而不增大OH-的浓度,可采取的措施是___________填字母)。
a.适当升高温度 b.加入NH4Cl固体
c.通入NH3 d.加入少量浓盐酸
(2) 常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,两溶液中的c(H+)变化情况是:
醋酸溶液中c(H+) _____________________(填“增大”、“减小”或“不变”),盐酸溶液中c(H+) __________________(填“增大”、“减小”或“不变”)
②加水稀释10倍后:醋酸溶液中的c(H+)________盐酸溶液中的c(H+)(填“>”、“=”或“<”)。
③加等浓度的NaOH溶液至恰好中和,所消耗的NaOH溶液体积相比较:醋酸_____________盐酸(填“>”、“=”或“<”)。
④使温度都升高20 ℃后,两溶液中c(H+)比较:醋酸____________盐酸(填“>”、“=”或“<”)。
⑤ 分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_________________(填字母,①代表盐酸,②代表醋酸溶液)。

(3) 将0.1 mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是_________________ (填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分数)与pH的关系如下图所示。下列叙述不正确的是( )
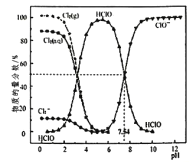
A. 新制氯水中持续通入SO2,pH不断变小,溶液颜色不断变浅
B. 新制的pH=l的氯水中,c(H+)>c(Cl3-)>c(HClO)
C. 25℃时,HC1O![]() H++ClO-的电离常数Ka的对数值为lgKa=-7.54
H++ClO-的电离常数Ka的对数值为lgKa=-7.54
D. pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为Cl2+2OH-=ClO-+C1-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1) 图1是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为______________。

③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2) 在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1) 25 ℃时,pH=3的盐酸中由水电离出的c(H+)是pH=5的盐酸中由水电离的c(H+)的________倍。
(2) 25 ℃时,某溶液由水电离出的c(H+)=1×10-12mol·L-1,则该溶液的pH可能为________。
(3) 99 ℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积Kw=________,水电离出的c(H+)=________,而此时溶液中的c(Na+)__________ c(SO42-) (填“>”“=”或“<”)。
(4) 25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”)。
(5) 25 ℃时,pH=3的醋酸和pH=11的NaOH溶液等体积混合后,
溶液呈________性(填“酸”“碱”或“中”)
溶液中c(Na+)________ c(CH3COO-) (填“>”“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】通过粮食发酵可获得某有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.
(1)X的分子式是;
(2)X与金属钠反应放出H2 , 反应化学方程式是(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是;
(4)X与高锰酸钾酸性溶液反应可生成Z.在加热和浓硫酸作用下,X与Z反应可生成一种无色具有水果香味的液体W,装置如图所示: 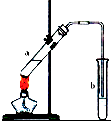
①生成液体W的化学方程式为;
②为了防止a中液体暴沸,加热前应采取的措施是;
③b试管中导管不能伸入到液面以下的理由是;
④试管b中加有饱和Na2CO3溶液,其作用是;
⑤若184g X和120g Z反应能生成106g W,则该反应的产率为 .
(已知 ![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 常温下,盐酸和醋酸溶液,c(Cl-)=c(CH3COO-),做导电性实验,醋酸的灯泡更亮
B. amolFeS与bmolFeO投入到VLcmol/L的稀硝酸溶液中充分反应,所得溶液成分看作Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(3a+3b)mol
C. AgI悬浊液中加入少量KI粉末,AgI(s)![]() Ag+(aq)+I-(aq)左移,溶液中离子总浓度增大
Ag+(aq)+I-(aq)左移,溶液中离子总浓度增大
D. 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液MnO4-也可以氧化Br-
查看答案和解析>>
科目: 来源: 题型:
【题目】活性炭可处理大气污染物NO.T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始状态 | 2.030 | 0.100 | 0 | 0 |
2min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2min内,用NO表示该反应的平均速率v(NO)=molL﹣1min﹣1 .
(2)该反应的化学方程式是 .
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是 .
①v(NO):v(A):v(B)=2:1:1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
①a处通入的物质是 , 电极反应式为:;
②b处电极反应式为;
③电池工作时H+由极移向极(填正、负极).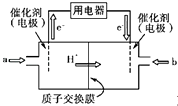
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 .
(2)元素Y与元素Z相比,金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填序号).
A.Y单质的熔点比Z单质低B.Y的化合价比Z低C.Y单质与水反应比Z单质剧烈D.Y最高价氧化物的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,写出该化合物的化学式 , 该化合物与CO2反应的化学方程式为 .
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com