
科目: 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-===4OH-
C. H+由a极通过固体酸电解质传递到b极
D. 每转移0.1 mol电子,消耗1.12L的H2
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
a(g) + b(g) ![]() 2c(g) △H1<0 x(g) + 3y(g)
2c(g) △H1<0 x(g) + 3y(g) ![]() 2z(g) △H2 >0
2z(g) △H2 >0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是
A. 等压时,通入惰性气体,c的物质的量不变
B. 等压时,通入z气体,反应器中温度升高
C. 等容时,通入惰性气体,各反应速率不变
D. 等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关能源和反应中的能量变化的说法正确的是
A.煤、石油、天然气都是化石能源,且均属于可再生能源
B.煤液化生成的甲醇属于二次能源
C.吸热反应都需要在加热或高温条件下才能进行
D.有化学键形成的反应一定是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是
A. 物质的量浓度之比为2∶1的NaClO、NaHSO3混合溶液中:c(HClO)+c(ClO-)=2c(HSO)+2c(H2SO3)+2c(SO![]() )
)
B. 物质的量浓度相等的① NH4HSO4溶液、② NH4HCO3溶液、③ NH4Cl溶液中,pH的大小关系:②>①>③
C. 常温下,pH=6的NaHSO3溶液中:c(SO![]() )-c(H2SO3)=9×10-7 mol·L-1
)-c(H2SO3)=9×10-7 mol·L-1
D. 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是( )
A. MnO4-,K+,Na+,SO42- B. Na+,K+,HCO3-,Cl-
C. Na+,NH4+,Cl-,NO3- D. Ba2+,K+,S2-,SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃,某溶液中含有Na+、H+、Fe3+、![]() 、OH-、I-中的几种离子,已知由水电离出的c(H+)=1×10-13 mol·L-1。向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色。下列关于该溶液的分析,错误的是
、OH-、I-中的几种离子,已知由水电离出的c(H+)=1×10-13 mol·L-1。向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色。下列关于该溶液的分析,错误的是
A. pH=1或pH=13
B. 阴离子肯定有I-,不能确定有无![]()
C. 阳离子肯定没有Fe3+,不能确定有无Na+
D. 溶质有3种可能:①HI ②HI和NaI ③NaI和NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】已知蓝色硫酸铜溶液会跟无色溴离子作用,生成绿色的四溴合铜离子: CuSO4(aq蓝色)+4KBr(aq)![]() K2[CuBr4](aq绿色)+K2SO4(aq),当温度升高时,该溶液中四溴合铜离子的浓度增大,所以溶液呈绿色。下列说法正确的是
K2[CuBr4](aq绿色)+K2SO4(aq),当温度升高时,该溶液中四溴合铜离子的浓度增大,所以溶液呈绿色。下列说法正确的是
A. 加入K2SO4溶液,平衡向左移动 B. 加水平衡不移动
C. 加入K2SO4固体,平衡向左移动 D. 正反应放热
查看答案和解析>>
科目: 来源: 题型:
【题目】化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
2FeCl3+2HI===2FeCl2+I2+2HCl 2Co(OH)3+6HCl===2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH===2Fe(OH)3+2KI 3I2+6KOH===5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3===2KSCN+CO2↑+H2O KCN+CO2+H2O===HCN+KHCO3
热分解反应:
4NaClO![]() 3NaCl+NaClO4 NaClO4
3NaCl+NaClO4 NaClO4![]() NaCl+2O2↑
NaCl+2O2↑
下列说法不正确的是
A. 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 B. 还原性(碱性溶液):Fe(OH)2>I2>KIO3
C. 热稳定性:NaCl>NaClO4>NaClO D. 酸性(水溶液):HSCN>H2CO3>HCN
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是
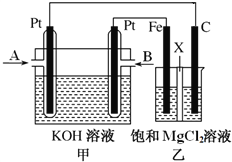
A. 甲中A处通入CH4,电极反应式为CH4+10OH--8e-=== ![]() +7H2O
+7H2O
B. 乙中电解MgCl2溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D. 甲、乙中电解质溶液的pH都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com