
科目: 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO ![]() 可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量氢氧化钠;③加适量盐酸;④加足量碳酸钠溶液;⑤加过量氯化钡溶液.下列操作顺序正确的是( )
可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量氢氧化钠;③加适量盐酸;④加足量碳酸钠溶液;⑤加过量氯化钡溶液.下列操作顺序正确的是( )
A.①④②⑤③
B.④①②⑤③
C.④②⑤①③
D.⑤②④①③
查看答案和解析>>
科目: 来源: 题型:
【题目】关于pH的测定下列说法正确的是( )
A. pH试纸在使用之前应用蒸馏水润湿
B. 用广泛pH试纸测得某盐酸的pH=2.3
C. 利用酸碱指示剂可以测溶液的pH
D. pH计是精确测定溶液pH的仪器
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,所含分子数相等的是( )
A.10g H2和10g O2
B.5.6g N2 (标准状况)和 11g CO2
C.9g H2O 和0.5mol Br2
D.224mL H2(标准状况)和0.1mol N2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A.国庆70周年放飞的气球材质是可降解材料,主要成分是聚乙烯
B.晶体硅可用来制造集成电路、晶体管、太阳能电池等
C.MgO与Al2O3均可用于耐高温材料
D.燃料的脱硫脱氮、NOx的催化转化都是减少酸雨产生的措施
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于铁元素的说法正确的是( )
A.预热的铁丝能在氯气中燃烧,生成棕褐色的烟雾
B.还原铁粉与浓硫酸共热,生成能使品红溶液褪色的气体
C.镀锌铁皮不易生锈,原因是使用了牺牲阴极的阳极保护法
D.向印刷电路板的废液中,加足量的铁粉,振荡,再滴入KSCN溶液显红色
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面。高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂。干燥的高铁酸钾受热易分解,在198℃以下是稳定的。高铁酸钾在水处理过程中涉及的变化过程有( )
①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A.①②③④B.①③④⑥C.②③④⑤D.②③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOx)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)①NH3催化氧化可制备硝酸。
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3=________________。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如下图所示。则p1________p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是______________________________。

③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为P2MPa。则500℃时该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_________________,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为____________mol。
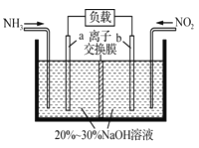
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
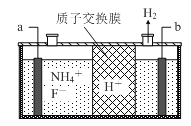
①a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:_____________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_____________________。
②已知氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,则NH4F的电子式为_____________,0.1mol/LNH4F溶液中所有离子浓度由大到小的顺序为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用,如回收利用电解精炼铜的阳极泥中含有的银、铂、金等贵重金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
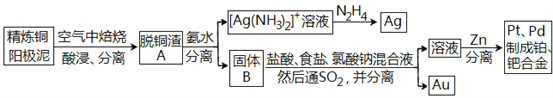
请回答下列问题:
(1)各步生产流程中都涉及了同一种分离方法,该方法需要的玻璃仪器有玻璃棒和_______。
(2)脱铜渣A中含有AgCl,它溶于浓氨水的离子方程式为________________。
(3)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4;在NaAuCl4中Au元素的化合价为______,该反应的离子方程式为____________________。
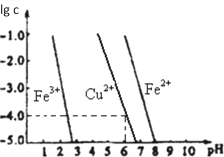
(5)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合如图分析:(其中的纵坐标代表金属阳离子浓度的对数)
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是_______________,然后加入适量的CuO调节pH=3.7,除去______离子;
②从图中数据计算可得Cu(OH)2的Ksp约为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com