
科目: 来源: 题型:
【题目】工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是

A. 电极a为电池的负极
B. 电极b上的电极反应式为:O2+4H++4e-=2H2O
C. 若电路中通过2 mol电子,则电池内部释放632 kJ热能
D. 若有17 g H2S参与反应,则会有1 mol H+经质子膜进入正极区
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃、101kPa下,断开1mol H2中的化学键需吸收436kJ的热量,断开1mol Cl2中的化学键需吸收243kJ的热量,断开1mol HCl分子中的化学键需吸收431kJ的热量,试求5mol H2和5mol Cl2完全反应的能量变化为kJ(填“吸收或放出”+能量数值).
查看答案和解析>>
科目: 来源: 题型:
【题目】已知将煤进行干馏,可以得到粗苯等物质,将苯与溴水混合,充分振荡后静置,用分液漏斗分出上层液体放置于一试管中,若向其中加入一种试剂,可发生反应并产生白雾,这种试剂是( )
A.浓H2SO4
B.HNO3
C.锌粉
D.铁粉
查看答案和解析>>
科目: 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: SO2(g) +1/2O2(g) ![]() SO3(g) △H=-98 kJ·mol- 1。
SO3(g) △H=-98 kJ·mol- 1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时 v(正)_____v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为____________ 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是(______)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.1mol·L-1 KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写) 。
(2)上述(B)操作的目的是 。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同) 。
(4)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点。判断到达终点的现象是 。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是 。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: 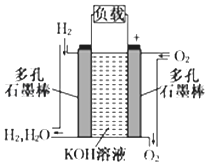
(1)通入氢气的一极为极.
(2)写出氢氧燃料电池工作时正极电极反应方程式: .
(3)该氢氧燃料电池每转移0.3mol电子,消耗标准状态下L氧气.
(4)若将此燃料电池改进为直接以甲醇(CH3OH)和氧气为原料进行工作时,负极反应式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸铜(Cu2(OH)2CO3)是名贵的矿物宝石孔雀石的主要成分,应用广泛,如在无机工业中用于制造各种铜化合物,有机工业中用作有机合成催化剂等等,某化学小组为了探究碱式碳酸铜生成条件对其产率的影响,设计了如下实验:
设计原理:取一定体积的碳酸钠溶液(0.5mol/L)于100mL烧杯中,进行加热,恒温后将硫酸铜溶液(5.00mL,0.5mol/L)在不断搅拌下以一定速度逐滴加入到上述碳酸钠溶液中,反应达平衡后,静止,减压过滤,洗涤,烘干,即得到最终产品,同时有气体放出。
(1)反应原理为:________________________________ 。
(2)探究反应原料用量比对反应产物的影响。
该化学小组根据所提供试剂设计两个实验,来说明反应原料用量对产品的影响。
提供试剂:0.5mol/LNa2CO3溶液、0.5mol/L CuSO4溶液
①填写下表的空白处:_____________、_____________。

②通过实验画图可知:当比值为_____________ ,碱式碳酸铜产量最好。

(3)反应温度对产率的影响
在三支试管中各加入2.0 mL 0.5 mol·L-1CuSO4溶液,另取四支试管各加入由上述实验得到的合适用量的0.5 mol·L-1 Na2CO3溶液。从这两列试管中各取一支将它们分别置于室温、30℃、50℃、100℃的环境中,数分钟后将CuSO4溶液倒入Na2CO3溶液中振荡并观察现象,发现:沉淀颜色分别为蓝色沉淀,绿色沉淀,深绿色沉淀,绿色中带有黑色沉淀,实验结果也如上图所示,请思考,为什么温度过高产率反而下降________________,该实验加热方式为_______________________。
(4)分析所制得的碱式碳酸铜的质量分数。
将已准确称量的0.5g试样放入300mL的锥形瓶中,加入5mL醋酸加热使其溶解,再用100mL水将其稀释。加入2.5gKI振荡混合,经过5分钟后,加入数滴淀粉溶液,用0.1mol/L的硫代硫酸钠溶液进行滴定。当_____________________ 时即达滴定的终点。
(5)反应的原理:2Cu2+ + 4I— == 2CuI + I2 ,I2+2 S2O32— == 2 I—+ S2O6 2—。 若消耗0.1mol/L硫代硫酸钠40 mL,则试样中铜的质量百分率为________________ 。
该溶液的滴定度为______________。(每毫升标准溶液相当于被测物质的质量,单位是g/mL或mg/mL)(保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定,请回答下列问题:
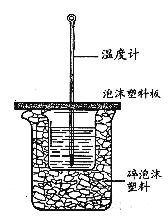
(1)大小烧杯之间填满碎泡沫塑料的作用是___________,做1次完整的中和热测定实验,温度计需使用________次,从实验装置上看,图中缺少的一种玻璃仪器是______________ 。
(2)使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与 50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容c为 4.18J/ (g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= ______ , H2SO4与NaOH反应的热化学方程式_______________ 。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_______。(填“偏大”、“偏小”、“不受影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)研究表明,将适量的十萘奈置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是______________________________________________________。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。


①在8 h时,反应体系内氢气的量为__________mol(忽略其他副反应)。
②x1显著低于x2的原因是________________________________________。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图。
Ⅱ.科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。
(4)电极反应式:________________________________和2Fe+3H2O+N2=Fe2O3+2NH3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com