
科目: 来源: 题型:
【题目】在氯碱工业中,原料盐中的杂质离子危害很高,能破坏离子膜,以下对Ca2+、Mg2+、Fe3+、SO42-除去顺序不合理的是 ( )
A.BaCl2、NaOH、Na2CO3
B.BaCl2、Na2CO3、NaOH
C.NaOH、BaCl2、Na2CO3
D.Na2CO3、BaCl2、NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:(已知TeO2微溶于水,易溶于强酸和强碱)
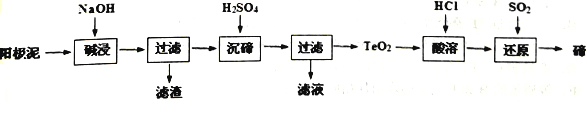
下列有关说法不正确的是
A. 将阳极泥研磨、反应适当加热都有利于提高“碱浸”的速率和效率
B. “沉碲”时为使碲元素沉淀充分,应加入过量的硫酸
C. “碱浸”时发生主要反应的离子方程式为TeO2+2OH-=TeO32-+H2O
D. 若提取过程碲元素的回收率为90%,则处理IKg这种阳极泥最少需通入标准状况下SO220.16L
查看答案和解析>>
科目: 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强碱性和强还原性的液体,是一种重要的化工试剂,某新型生产工艺设计如下:
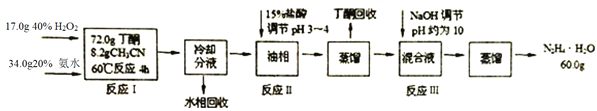
己知:①乙腈CH3CN:无色液体,与水任意比例互溶:丁酮![]() :无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
:无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
②反应 I 的化学方程式为:2NH3+ H2O2+![]()
![]()
![]() +4H2O
+4H2O
请回答:
(1)反应I中H2O2需逐滴滴加至混合溶液中,原因是______________________________;
(2)该新型生产工艺可将水相和丁酮回收循环使用,实现清洁化生产,水相的主要溶质成分是_____________________________;
(3)反应II加入盐酸操作的实验装置如图所示,虚线框内最为合适的仪器是_________,优点是___________。

(4)在加入足量盐酸后,肼以盐的形式存在请写出反应Ⅲ的化学方程式_________;
(5)称取水合肼馏分1.00g,加水配成2.0mL溶液,在一定条件下,用0.300mol/L的I2溶液滴定,来测定水合肼的产率。
已知:N2H4·H2O+2I2=N2↑+4HI+H2O。
①滴定时,可选用的指示剂为_________;
②实验测得消耗I2溶液的平均值为20.00mL,则N2H4·H2O的产率为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在Na+浓度为1.0 molL-1的某澄清溶液中,还可能含有K+、Mg2+、Fe3+、Ba2+、CO32-、SO32-、SiO32-、Cl-、SO42-等离子,取该溶液100mL 进行下图连续实验(所加试剂均过量,气体全部逸出)。下列说法不正确的是

A. 原溶液中一定不存在Mg2+、Fe3+、Ba2+、SO42-
B. 在l00mL原溶液中加入足量BaCl2溶液,至少可生成沉淀20.5g
C. 为确定原溶液中是否含有Cl-,可取滤液C,加入AgNO3和稀HNO3溶液
D. 原溶液一定存在K+,c(K+)可能为1.5 molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】压强变化不会使下列化学反应的平衡发生移动的是 ( )
A. H2(气)+I2(气) ![]() 2HI(气)
2HI(气)
B. 3H2(气)+N2(气) ![]() 2NH3(气)
2NH3(气)
C. 2SO2(气)+O2(气) ![]() 2SO3(气)
2SO3(气)
D. C(固)+CO2(气) ![]() 2CO(气)
2CO(气)
查看答案和解析>>
科目: 来源: 题型:
【题目】电解CuSO4溶液时,若要达到如下三个要求:①阳极质量减小;②阴极质量增加;③电解质溶液中Cu2+浓度不变。则选用的电极是( )
A.纯铜作阳极,含锌、银的铜合金作阴极
B.铁作阳极,铜作阴极
C.石墨作阳极,铂作阴极
D.含锌、银的铜合金作阳极,纯铜作阴极
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生反应X(g)+2Y(g)![]() 3Z(g)△H=-akJ·mol-1(a>0),下列说法正确的是
3Z(g)△H=-akJ·mol-1(a>0),下列说法正确的是
A. 容器内气体的压强不再发生变化,说明反应达到平衡状态
B. 达到化学平衡状态时,反应放出的总热量可能为akJ
C. 当X、Y、Z的浓度之比为1:2:3时,反应达到化学平衡状态
D. 降低反应温度,正反应速率增大,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com