
科目: 来源: 题型:
【题目】正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.
(1)反应的总方程式为正极的电极反应式为 .
(2)H+的迁移方向为由到 . (填“左右”)
(3)若 11.2L(标准状况)SO2 参与反应,则迁移 H+的物质的量为 .
(4)下列化学电池不易造成环境污染的是
A.氢氧燃料电池
B.锌锰电池
C.镍镉电池
D.铅蓄电池
(5)某同学关于原电池的笔记中,不合理的有 ①原电池两电极 活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe﹣NaOH 溶液﹣Si 原电池,Fe 是负极.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是
A. 二氧化硫可用于杀菌、消毒
B. 氯气可用于消毒和制造漂白粉
C. 碳酸钠可用作食用碱
D. 四氧化三铁可用作红色涂料
查看答案和解析>>
科目: 来源: 题型:
【题目】用萃取法从碘水中分离碘,所用萃取剂应具有的性质是( ) ①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
A.①②⑤
B.②③④
C.①③⑤
D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验兴趣小组用如下两种方法制取氮气。

已知:活性炭可用于吸附水中的絮状沉淀。
(1)方法一所发生反应的化学方程式为_________________。
(2)检验方法一反应后所得溶液中是否含有NH4+的实验方法是_________________。
(3)方法二被冰水冷却的U 型管中所得物质是_________________,用冰水冷却的目的是_________________。
(4)方法一与方法二相比所具有的优点是_________________。
(5)方法一和方法二中均需用到NH4Cl,NH4Cl的溶解度随温度变化的曲线如右图所示,工业NH4Cl固体中含有少量的FeCl2,可通过如下实验来提纯:将工业NH4Cl固体溶于水,_________,调节溶液的pH为4~5,向溶液中加入活性炭,将溶液加热浓缩,________获得纯净的NH4Cl固体。(实验中可供选择的试剂有:双氧水、KMnO4溶液)
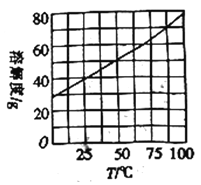
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如下图:
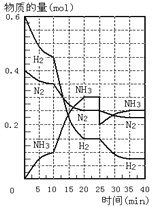
(1)计算反应开始10分钟内,NH3的平均反应速率___________
(2)反应处于平衡状态的时间是:__________________________
(3)图中10~20分钟曲线发生变化的可能原因是_______________。
(4)第25分钟,平衡改变的条件是____________________,此时正反应速率_____(填增大、减小或不变),重新达平衡后,NH3的体积分数比原平衡______(填大、小或不变)。
(5)判断该反应达到平衡状态的标志是_________________________(填字母);
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是一个电化学过程的示意图,请回答下列问题:

(1)图中甲池是_________ (填“原电池” “电解池”或“电镀池”)。
(2)A(石墨)电极的名称是_________ (填“正极” “负极” “阴极”或“阳极”)
(3)写出通入CH3OH的电极的电极反应式________________
(4)乙池中反应的化学方程式为__________________。当乙池中B(Ag)极质量增加54g,甲池中理论上消耗O2的体积为____L(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子组在溶液中因发生氧化还原反应而不能大量共存的是
A. H+、NO3ˉ、Fe2+、Na+ B. K+、Ba2+、OHˉ、SO42ˉ
C. Ag+、NO3ˉ、Clˉ、K+ D. Cu2+、NH4+、Brˉ、OHˉ
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度为1mol/L的是( )
A.将40gNaOH溶于1L水所得的溶液
B.将80g SO3溶于水并配成1L的溶液
C.将0.5mol/L的NaNO3溶液100mL加热蒸发掉50g水的溶液
D.含K+为2mol的K2SO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在 5L 的密闭容器中发生如下反应:N2 (g)+3H2 (g)2NH3(g),起初充入的 3.0mol N2 和 6.0mol H2 , 5 分钟后达到平衡,此时容器内压强是开始时的 ![]() ,问:
,问:
(1)氢气的平衡转化率为;
(2)用氨气表示 5min 内的反应速率为
(3)若要使氮气和氢气的平衡转化率相等,起始投料要求 n(H2 ):n(N2 )为
(4)以下措施能加快反应速率的是
A.缩小体积,使压强增大
B.恒温恒容充入 He 使压强增大
C.恒温恒压充入 He
D.平衡后加入催化剂
(5)如果利用此反应设计成原电池,并用稀硫酸做电解液,分别写出正、负极的电极反应 式:、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com