
科目: 来源: 题型:
【题目】下列说法中正确的是
A. 溶液中的溶质粒子能透过滤纸,而胶体中的分散质粒子不能透过滤纸,所以可以用滤纸来分离溶液和胶体
B. 有化学键断裂或化学键形成的过程都是化学变化
C. 焰色反应属于吸热反应
D. 食盐溶液能导电,但食盐溶液不是电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)⑦的最低负价是;⑧的最高价含氧酸的化学式为 .
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为 .
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 .
(4)⑤、⑥的单质中更容易与①的单质反应的是 .
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式 .
(6)用电子式表示③和⑨组成的化合物的形成过程 .
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示真核细胞某些结构的主要组成成分(字母是元素符号),下列叙述正确的是( )

A. 结构1功能的复杂程度主要是由图中乙的种类和数量直接决定的
B. 物质乙、丙的单体分别是氨基酸和核糖核苷酸
C. 原核细胞无结构1,但含有乙、丙物质
D. 该真核细胞的遗传物质主要是丙
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于碱金属元素(M)的单质及其化合物说法不正确的是
A. 随核电荷数递增单质的熔点依次降低、硬度依次减小
B. 化合物中M的化合价均为+1价
C. 单质在空气中都剧烈反应,生成M2O2
D. 随核电荷数递增单质与水反应的剧烈程度变强
查看答案和解析>>
科目: 来源: 题型:
【题目】已知5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B形成离子化合物A2B,A2B中所有粒子的电子数相同,A2B中电子总数为30;D和E可形成4核10电子的分子.试回答下列问题:
(1)写出5种元素的名称:A、B、C、D、E .
(2)写出下列物质的电子式:D元素形成的单质;B与E形成的化合物;A、B、E形成的化合物;D、E形成的化合物 .
(3)A、B两元素组成的化合物A2B2属于(填“离子”或“共价”)化合物,存在的化学键是 , 写出A2B2与水反应的化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高经济效益,而且还能防止环境污染,生产流程如下: 
已知石油裂解已成为生产H的主要方法,E的溶液能发生银镜反应,G是具有香味的液体,试填空.
(1)A的名称;G的名称;
(2)B的结构简式;H的结构简式;
(3)写出H发生加聚反应的方程式:;
(4)D→E的化学方程式:;
(5)E→F的化学方程式:;
(6)F→G的化学方程式;
(7)写出G的一种与CH3COOH互为同系物的同分异构体的结构简式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )

A. 分子中含有5种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是
A、碳酸钙溶解于稀硝酸中:CO32—+2H+==CO2↑+H2O
B、氯化钠溶液中滴加硝酸银溶液:Cl—+AgNO3==AgCl↓+NO3—
C、盐酸中滴入氨水:H++OH—==H2O
D、碳酸氢钠溶液与NaOH溶液混合:HCO3—+OH—==CO32—+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
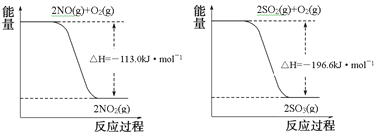
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___________________。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。

①a、c两点反应速率大小关系:υ(a)________υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为_____________,此温度下该反应的平衡常数为____________,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30mol SO2,NO2的转化率_________________。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是: ____________________。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32―)∶n(HSO3―)变化关系如下表:
n(SO32―)∶n(HSO3―) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为______________。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是不同温度下水的离子积数据:

试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”),作此判断的理由是______。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L﹣1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=__________。
(3)在t2℃下,pH=10的NaOH溶液中,水电离产生的OH-为浓度为_________。
(4)t2℃下,将pH=11的NaOH溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=________。
(5)有H+浓度相同、体积相等的三种酸:a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率大小顺序为_____;反应完全后生成H2的质量大小关系为____(用abc表示酸)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com