
【题目】下列关于碱金属元素(M)的单质及其化合物说法不正确的是
A. 随核电荷数递增单质的熔点依次降低、硬度依次减小
B. 化合物中M的化合价均为+1价
C. 单质在空气中都剧烈反应,生成M2O2
D. 随核电荷数递增单质与水反应的剧烈程度变强
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组用如下两种方法制取氮气。

已知:活性炭可用于吸附水中的絮状沉淀。
(1)方法一所发生反应的化学方程式为_________________。
(2)检验方法一反应后所得溶液中是否含有NH4+的实验方法是_________________。
(3)方法二被冰水冷却的U 型管中所得物质是_________________,用冰水冷却的目的是_________________。
(4)方法一与方法二相比所具有的优点是_________________。
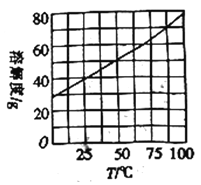
(5)方法一和方法二中均需用到NH4Cl,NH4Cl的溶解度随温度变化的曲线如右图所示,工业NH4Cl固体中含有少量的FeCl2,可通过如下实验来提纯:将工业NH4Cl固体溶于水,_________,调节溶液的pH为4~5,向溶液中加入活性炭,将溶液加热浓缩,________获得纯净的NH4Cl固体。(实验中可供选择的试剂有:双氧水、KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取高纯MnO2的流程如下:
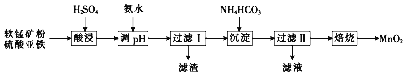
(1)酸浸时所发生主要反应的离子方程式为_____________。
(2)酸浸时加入一定体积的硫酸,硫酸浓度不能过小或过大。当硫酸浓度偏小时,酸浸时会有红褐色渣出现,原因是_______。硫酸浓度不能过大的原因是_____________。
(3)过滤Ⅱ所得滤渣为MnCO3,滤液中溶质的主要成分是_____。
(4)焙烧MnCO3的装置如下图所示:
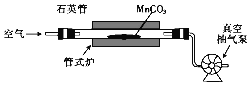
①焙烧时所发生反应的化学方程式为__________。
②焙烧一定时间后需转动石英管,目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 在一定温度下,固定体积的密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
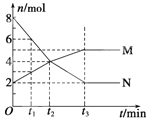
A. t1时,N的浓度是M浓度的2倍
B. t2时,正逆反应速率相等达到平衡
C. t3时,正反应速率大于逆反应速率
D. 此反应的化学方程式为M ![]() 2N
2N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
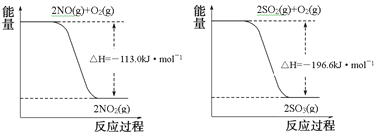
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___________________。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。

①a、c两点反应速率大小关系:υ(a)________υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为_____________,此温度下该反应的平衡常数为____________,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30mol SO2,NO2的转化率_________________。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是: ____________________。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32―)∶n(HSO3―)变化关系如下表:
n(SO32―)∶n(HSO3―) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为______________。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 铁粉与氯气反应只能生成FeCl3
B. Cl2具有很强的氧化性,在化学反应中只能作氧化剂
C. 11.2LCl2的质量为35.5g
D. 保存氢氟酸时, 常用带橡胶塞的玻璃瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A.半导体材料砷化镓
B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌
D.超导材K3C60
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com