
科目: 来源: 题型:
【题目】Cl2和SO2都具有漂白作用,若将等物质的量的这两种气体混合通入品红与BaCl2的混合溶液中,能观察到的现象是: ①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目: 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32ˉ、SO32ˉ、SO42ˉ、C1ˉ中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法不正确的是( ) 
A.气体A是NO
B.X中不能确定的离子是 A13+和C1ˉ
C.溶液E和气体F能发生化学反应
D.X中肯定存在Fe2+、A13+、NH4+、SO42ˉ
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如图所示。下列说法错误的是( )
CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如图所示。下列说法错误的是( )
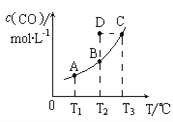
A. 该反应的ΔH>0
B. 若T1、T2时的平衡常数分别为K1、K2,则K1=K2
C. 通过加热可以使B点变到C点
D. 在T2时若反应进行到状态D,则一定有v (正) < v (逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】以下自发反应能用ΔH判据来解释的是( )
A. 硝酸铵自发地溶于水
B. 2N2O5(g)===4NO2(g)+O2(g) ΔH=+156.7 kJ·mol-1
C. (NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将碳酸钠溶液加热至70℃,其结果是( )
A. 溶液中c(CO32-)增大 B. 水的电离程度不变
C. 溶液的pH将变小 D. 溶液的碱性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是

A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 庚的最高价氧化物水化物酸性最强
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如图所示。

已知:
沉淀物 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
(1)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是______(填化学式)。
(2)请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,写出相关的两个离子方程式______、______。
(3)将溶液C调节pH,pH的范围是______。
A.3.2≤pH≤4.7 B.3.2≤pH<4.7 C.3.2<pH<4.7D.3.2<pH≤4.7
(4)要制得更纯的Cu(NO3)2·6H2O晶体,可进行的操作是______(填操作名称)。
(5)操作Ⅱ的具体操作是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)烧杯间填满碎纸条的作用是________________________;
(3)大烧杯上如不盖硬纸板,求得的中和热数值_____(填“偏大”“偏小”“无影响”);
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),简述理由______________________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
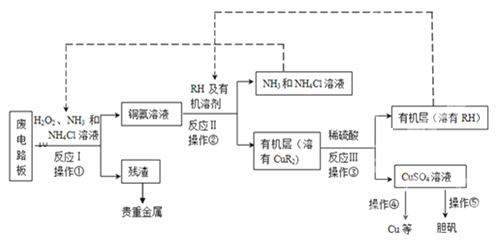
回答下列问题:
(1)反应I是将Cu转化为Cu(NH3)42+,反应中H2O2 的作用是_________________。请写出操作①的名称:________________。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,请写出该反应的离子方程式:_________________。操作②用到的主要仪器名称为___________,其目的是(填序号)__________。
a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应III除了生成CuSO4之外,还生成另外一种产物是___________。
(4)操作④以石墨作电极电解CuSO4溶液,电解时的总反应式为________________。操作⑤由硫酸铜溶液制胆矾的主要步骤是___________________________________。
(5)流程中有三次实现试剂的循环使用,已用虚线标出两处,第三处的试剂是______。循环使用的NH4Cl在反应I中的主要作用是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com