
科目: 来源: 题型:
【题目】【选修5:有机化学基础】具有抗菌作用的白头翁素衍生物H的合成路线如图所示

已知: ①.RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
②.R﹣HC═CH﹣R′![]()
![]()
③.R﹣HC═CH﹣R′![]()

(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是____。C中官能团的名称是____。
(2)H的分子式为____,由G生成H的反应类型为____。
(3)试剂a的结构简式是____,试剂b为____。
(4)由C生成D的化学方程式是____。
(5)E与I2在一定条件下反应生成F的产物不唯一,此反应同时生成另外一种有机副产物且与F互为同分异构体,此有机副产物的结构简式是____。
(6)下列说法正确的是____。
A.E中含有3种官能团
B.1mol H与足量NaOH溶液反应,消耗2mol NaOH
C.由F生成G的反应是消去反应
D.1mol G最多可以与3mol H2发生加成反应
(7)与化合物C具有相同官能团且属于芳香族化合物的同分异构体共有____种(包括C本身)。
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
B. 1mol该有机物与NaOH溶液反应,最多消耗3mol NaOH
C. 分枝酸的分子式为C10H8O6
D. 分枝酸分子中含有2种含氧官能团
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为__________________。
(2)利用如图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________________处。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量____3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是______________________,若将开关K置于N处,发生的总反应是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图回答,下列说法不正确的是( )
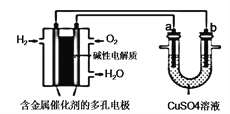
A. 此装置用于电镀铜时,电解一段时间,理论上硫酸铜溶液的浓度不变
B. 若a为粗铜,b为纯铜,该装置可用于粗铜的电解精炼
C. 燃料电池中负极反应为2H2-4e-+4OH- = 4H2O
D. 上述装置在工作过程中Cu2+ 向a电极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空。
(1)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
①与汽油相比,氢气作为燃料的优点是_____________________(至少答出两点)。
②利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为____________。
(2)有机物M经过太阳光光照可转化成N,转化过程如下:
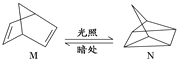 ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是____________。
ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是____________。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛一定比例混合高温下煅烧,产物可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s)ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为______________。
(4)在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
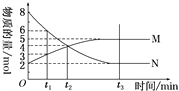
①该反应的化学方程式为____________________________。
②若t2=2 min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为______________。
③t2时刻,反应物的转化率为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是环保部门监测有害气体常用的一种药品,它易溶于水,遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图。

实验具体操作步骤为:
①打开分液漏斗使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
(1)写出仪器A的名称____。
(2)写出A中发生反应的化学方程式____。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是____。
(4)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42离子,该反应的离子方程式为____。
(5) 为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下图装置进行实验。
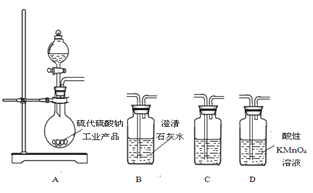
①实验装置的连接顺序依次是____(填装置的字母代号),装置C中的试剂为____。
②能证明固体中含有碳酸钠的实验现象是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
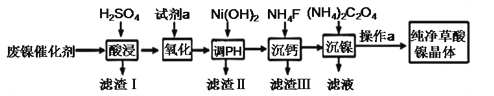
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×1010
(1)“酸浸”前将废镍催化剂粉碎的目的是:____。“滤渣Ⅰ”的主要成分为:____。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____。
(3)调节pH的范围为:____。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____,NH4F的电子式为:____。
(5)如果“沉镍”操作后测得滤液中C2O42 的浓度为0.18 mol·L1,则溶液中c(Ni2+)= ____ mol·L1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com