
科目: 来源: 题型:
+ 3 |
2- 3 |
2- 4 |
+ 3 |
+ 3 |
2- 4 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
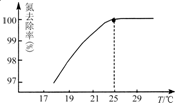 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
+ 4 |
+ 4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
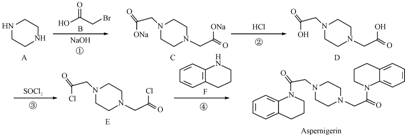
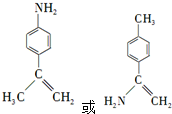

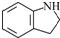 为原料,写出制备
为原料,写出制备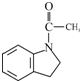 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| HaBr |
| NaOHr溶液 |
| △ |
查看答案和解析>>
科目: 来源: 题型:
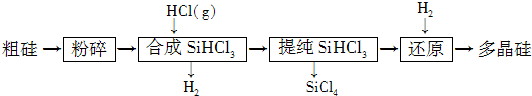
| c3(HCl) |
| c(SiHCl)×c(H2) |
| c3(HCl) |
| c(SiHCl)×c(H2) |
查看答案和解析>>
科目: 来源: 题型:
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
查看答案和解析>>
科目: 来源: 题型:
下列根据实验操作和现象所得出的结论不正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com