
科目: 来源: 题型:
【题目】在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是( )
A.92.3%
B.87.6%
C.75%
D.84%
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类(填序号).
①CH3CH2OH ② ![]() ③CH3CH2Br ④
③CH3CH2Br ④ ![]() ⑤
⑤ ![]() ⑥
⑥ ![]() ⑦
⑦ ![]() ⑧
⑧ ![]() ⑨
⑨ ![]() ⑩
⑩ ![]()
(1)芳香烃:;
(2)卤代烃:;
(3)醇:;
(4)酚:;
(5)醛:;
(6)酮:;
(7)羧酸:;
(8)酯: .
查看答案和解析>>
科目: 来源: 题型:
【题目】在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液浓度偏高的是
A.用量筒量取浓盐酸时仰视读数
B.溶解搅拌时有液体飞溅
C.定容时仰视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,明显不正确的是( )
A. 分散系的分类
分散系的分类
B. 稀释浓氢氧化钠溶液的过程
稀释浓氢氧化钠溶液的过程
C. 向碳酸钠溶液中逐滴滴加盐酸
向碳酸钠溶液中逐滴滴加盐酸
D. 向偏铝酸钠溶液中逐滴滴加盐酸
向偏铝酸钠溶液中逐滴滴加盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂.氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙在一定条件下与氧气反应生成的产物不只一种.氢化钙通常用氢气与金属钙加热制取,如图1是模拟制取装置. 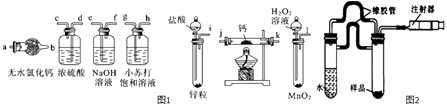
请回答下列问题:
(1)利用上述装置制取氢化钙时按气流方向连接顺序为(填仪器接口的字母编号).
i→→→→→→→a
(2)装有无水氯化钙装置的作用是 .
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;(请按正确的顺序填入下列步骤的标号).
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(4)甲同学设计了一个实验,测定上述实验中得到的氢化钙的纯度.请完善下列实验步骤:
①样品称量;
②加入溶液(填化学式),搅拌;
③(填操作名称);洗涤;干燥
④称量碳酸钙.
(5)利用上述题目中给出的装置(试剂可另选)设计实验,用化学方法证明产物中含有氢化钙,写出实验简要步骤及观察到的现象 .
(6)乙同学利用图2所示装置测定上述实验中得到的氢化钙的纯度.他称取46mg所制得的氢化钙样品,记录开始时注射器活栓停留在lO.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定).试通过计算求样品中氢化钙的纯度: .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003molL﹣1s﹣1 . ,则6s时c(A)=molL﹣1 , C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为 , 如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母): a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是(填写元素符号).
(2)①和④号元素形成的化合物的化学式为 , 用电子式表示其形成过程为 .
(3)⑧号元素的最高价氧化物的水化物的化学式是 .
(4)①、⑤、⑦号元素形成的一种化合物的电子式是 , 在该化合物中既含有键,又含有键.
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.2.8g铁与0.05mol Cl2充分反应,转移0.15NA电子
B.27g Al与足量NaOH溶液反应生成 33.6L H2
C.14g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA
D.0.1mol Na2O2与足量二氧化碳反应转移0.2NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A.
图中测定锌粒与1 mol/L稀硫酸反应速率,只需测定量筒中收集氢气的体积
B.
装置中进行50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液测定中和热,使温度计温度升高的热量就是中和反应生成1 mol水的热量
C.
酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁以减小实验误差
D.![]()
滴定管中读数为26.50mL
查看答案和解析>>
科目: 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3 , 还含少量二价铁和三价铁的氧化物及硅的氧化物.如图1是实验室以孔雀石为原料制备胆矾晶体的流程图: 
请回答下列问题:
(1)溶液A中的金属离子有 . 从下列所给试剂中选择:实验步骤中试剂①为(填代号)
a、KMnO4 b、HNO3c、H2O2 d、Cl2
(2)根据图2有关数据,你认为工业上加入试剂①氧化操作时应采取的措施是:溶液温度控制在℃,pH控制在 , 氧化时间为小时左右.
(3)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4﹣还原为Mn2+ , 取A溶液20.00mL,用去0.0240mol/L KMnO4溶液16.00mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为mol/L.
(4)请设计一种实验方案检验溶液C中Fe3+是否完全除去(写出操作步骤、现象和结论) .
(5)由溶液C获得胆矾晶体,需要经过蒸发浓缩、、过滤等操作.除烧杯漏斗外过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 .
(6)为测定胆矾中结晶水数目,称取24.8g硫酸铜晶体盛装在干燥的
(填仪器名称)里,灼烧至质量不再改变时,称量粉末的质量为16.0g.,则计算得胆矾(CuSO4nH2O)中n=(计算结果精确到0.1).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com