
科目: 来源: 题型:
【题目】海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图。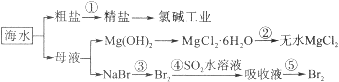
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的。
(2)除去粗盐溶液中的杂质(Mg2+、SO42-、Ca2+),加入药品的顺序可以为。
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
(3)过程②中由MgCl2·6H2O制得无水MgCl2 , 应如何操作。
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将转化为的过程。采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式。
(5)从第③步到第④步的目的是。采用“空气吹出法”从浓海水中吹出Br2 , 并用SO2吸收。主要反应的化学方程式为。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列实验各装置图的叙述,不正确的是( ) 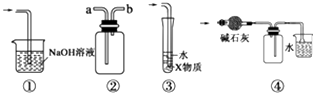
A.装置①可用于吸收实验中多余的Cl2
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④中可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制取硝酸铵的流程图如下,请回答下列问题:
(1)合成氨的工业设备名称是 , 设备中设置热交换器的目的是;此生产过程中,N2与H2合成NH3所用的催化剂是;生产中原料气必须进行脱硫,目的是。
(2)吸收塔中的反应为 , 从生产流程看,吸收塔中需要补充空气,其原因是。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下三种方法处理:
方法一:碱吸收法:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+Na2CO3=NaNO2+NaNO3+CO2
方法二:氨还原法:8NH3+6NO2=7N2+12H2O(该反应放热,NO也有类似的反应)
方法三:甲烷吸收法:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=+867kJ·mol-1(NO也有类似的反应)上述三种方法中方法一最大的缺点是;方法三和方法二相比,优点是 , 缺点是。
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用的NH3的质量占总耗NH3质量(不考虑其他损耗)的%(保留三位有效数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: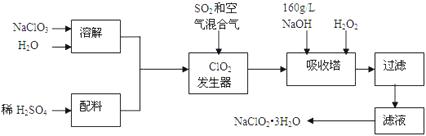
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO23H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中发生反应的离子方程式为。发生器中鼓入空气的作用可能是。
a.将SO2氧化成SO3 , 增强酸性 b.将NaClO3还原为ClO2 c.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为;吸收塔内的温度不能超过20℃,其目的是。
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。以下还可以选择的还原剂是(选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 ml待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml 。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简。)
查看答案和解析>>
科目: 来源: 题型:
【题目】Cl2及其化合物在生产、生活中具有广泛的用途。25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图一所示。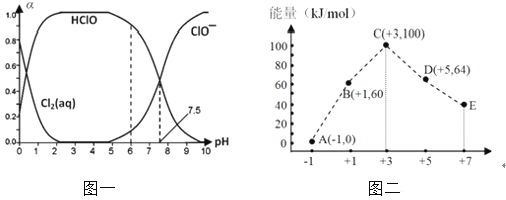
(1)已知HClO的杀菌能力比ClO-强,由图一分析,用氯气处理饮用水时,pH=7.5与pH=6时杀菌效果强的是。氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为。
(2)ClO2是一种易爆炸的强氧化性气体,是一种良好的新型消毒剂。工业上可用Cl2氧化NaClO2溶液制取ClO2 , 该反应的化学方程式为。最近,科学家又研究出了在酸性溶液中用草酸钠(Na2C2O4)还原氯酸钠制取ClO2的方法,该反应的离子反应方程式为。此法的优点是。工业上还可用电解法制备ClO2 , 在80℃时电解氯化钠溶液得到NaClO3 , 然后与盐酸反应得到ClO2。电解过程中NaClO3在极(填“阴”或“阳”)生成,生成ClO3–的电极反应式为。
(3)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1、2、3、4)的能量大小与合价的关系如图二所示。从能量角度看,C、D、E中最不稳定的离子是(填离子符号)。B → A + D反应的热化学方程式为(用离子符号表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列反应的热化学方程式为
·(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣870.3kJmol﹣1
·(2)C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1
·(3)H2(g)+ ![]() O2(g)═H2O(l)△H3=﹣285.8kJmol﹣1
O2(g)═H2O(l)△H3=﹣285.8kJmol﹣1
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的△H为( )
A.﹣488.3 kJmol﹣1
B.﹣191 kJmol﹣1
C.﹣476.8 kJmol﹣1
D.﹣1 549.6 kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】将14g铜银合金与足量某浓度的硝酸反应,使放出的气体与1.12L(标准状况)氧气混合恰好被水全部吸收生成硝酸,则合金中铜的质量为( )
A.3.2g
B.4.43g
C.10.8g
D.12.4g
查看答案和解析>>
科目: 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)2C(g),若经2s后测得C的浓度为0.6molL﹣1 , 现有下列几种说法:
①用物质A表示的反应的平均速率为0.3molL﹣1s﹣1
②用物质B表示的反应的平均速率为0.6molL﹣1s﹣1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7molL﹣1
其中正确的是( )
A.①③
B.①④
C.②③
D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子
A. Fe2+ B. Fe3+ 和Fe2+ C. Cu2+ 和Fe2+ D. Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com