
科目: 来源: 题型:
【题目】A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L.反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L.则2min内反应的平均速率VB= , 该反应的化学反应方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
(1)一定温度下,向固定体积为2L的密闭容器中充入SO2和NO2各1mol,发生反应SO2(g)+NO2(g)SO3(g)+NO(g),测得上述反应5min末到达平衡,此时容器中NO与NO2的体积比为3:1,则这段时间内SO2的反应速率υ(SO2)= , 此反应在该温度下的平衡常数K= .
(2)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示: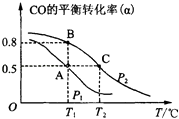
①上述合成甲醇的反应为反应(填“放热”或“吸热”).
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 . A、B两点对应的压强大小关系是PAPB(填“大于”、“小于”或“等于”).
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 , 理论上通过外电路的电子最多为 mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】关于元素周期表的说法正确的是( )
A.元素周期表中有8个主族
B.元素周期表中有7个周期
C.周期表中的主族都有金属元素
D.IA族中的元素全部是金属元素
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号).原子结构示意图为 .
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是;碱性最强的化合物的名称是 .
(3)最高价氧化物是两性氧化物的元素是;写出它的氧化物与氢氧化钠反应的化学方程式 .
(4)元素④与⑦的化合物属于(填“共价”或“离子”)化合物.
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿的主要成分是Al2O3 , 含有杂质SiO2、Fe2O3、MgO.工业上从铝土矿中提取铝可采用如图所示工艺流程: 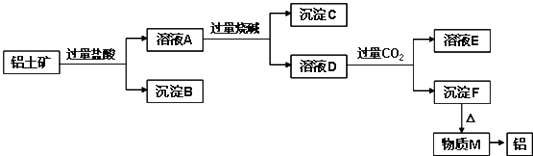
请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是(填操作名称).需要用到的玻璃 仪器、、
(2)沉淀B的成分是(填化学式,下同),沉淀C的成分是、;
(3)写出生成溶液D的离子方程式;
(4)沉淀F转化为物质M的化学方程式为;溶液D中通入过量CO2生成沉淀F的离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:N2(g)+3H2(g) ![]() 2NH3(g)(正反应为放热反应),2SO2(g)+O2(g)
2NH3(g)(正反应为放热反应),2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应)。
2SO3(g)(正反应为放热反应)。
请回答下列问题:
(1)从影响化学反应速率和化学平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施是。实际生产中采取的措施是、 。
(2)在合成氨的工业生产中,要分离出氨,目的是;而合成SO3的过程中,则不需要分离出SO3 , 原因是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com