
科目: 来源: 题型:
【题目】关于下列各图的叙述正确的是( )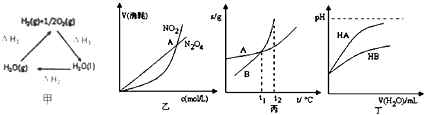
A.甲中△H1=﹣(△H2+△H3)
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A,B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH
查看答案和解析>>
科目: 来源: 题型:
【题目】Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
元素 | 相关信息 |
Q | Q的单质是实验室常用的惰性电极材料 |
R | R原子基态时2p原子轨道上有3个未成对电子 |
T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
X | X是第三周期电负性最大的元素 |
Y | 元素Y位于周期表第10列 |
Z | Z存在质量数为65,中子数为36的核素 |
(1)Z元素的原子基态时的电子排布式是
(2)下列叙述正确的是 a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2 . QT分子中σ键π键的个数比为;QT2分子中,Q原子采取杂化.
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构.故的空间构型为 , 且为(填“极性”或“非极性”)分子.
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如图所示.该晶体的化学式为;晶体中每个镁原子周围距离相等且最近的Y原子有个. 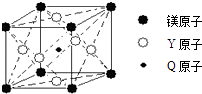
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为两个原电池装置图,由此判断下列说法错误的是( ) 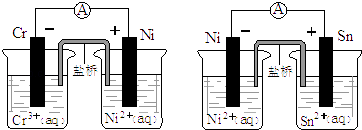
A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同
B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动
C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应
D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn
查看答案和解析>>
科目: 来源: 题型:
【题目】某液氨﹣液氧燃料电池示意图如上,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3molL﹣1 , 则该过程中需要氨气的质量为g(假设溶液电解后体积不变).
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( ) 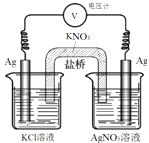
A.该装置工作时化学能转化为电能
B.左池中的银电极作正极
C.总反应为Ag+(aq)+Cl﹣(aq)AgCl(s)
D.盐桥中的K+向右池方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L.反应物A的浓度随时间的变化如图所示. 
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是: ②; .
③; .
(2)实验②平衡时B的转化率为;实验③平衡时C的浓度为;
(3)该反应的△H0,其判断理由是
(4)该反应进行到4.0min时的平均反应速率: 实验②:vB=
实验③:vc= .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应过程中,△H>0且△S>0的是( )
A.CaCO3(s)═CaO(s)+CO2(g)
B.NH3(g)+HCl(g)═NH4Cl(s)
C.4Al(s)+3O2(g)═2Al2O3(s)
D.H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)
查看答案和解析>>
科目: 来源: 题型:
【题目】磷及部分重要化合物的相互转化如图所示.
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是;
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol/L CuSO4溶液所能氧化的白磷的物质的量为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】用催化剂可以使NO、CO污染同时降低,2NO(g)+2CO(g)N2(g)+CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出如图.前1s内的平均反应速率v(N2)= , 第2s时的x值范围 . 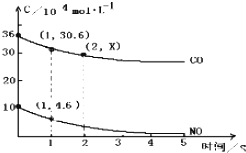
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com