
科目: 来源: 题型:
【题目】镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
浓度/(gL﹣1) | 63.7 | 28.8 | 144.6 | 46.4 |
再利用浓海水提镁的一段工艺流程如下图: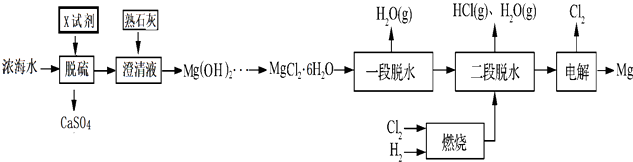
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是 . 在上述流程中,可以循环使用的物质是 .
(2)在该工艺过程中,X试剂的化学式为 .
(3)“一段脱水”目的是制备MgCl22H2O;“二段脱水”的目的是制备电解原料.若将MgCl26H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为 .
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为g.
(5)以LiCl﹣KCl共熔盐为电解质的Mg﹣V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4Li2O 该电池的正极反应式为 .
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则: Mg(s)+2B(s) MgB2(s)△H= . 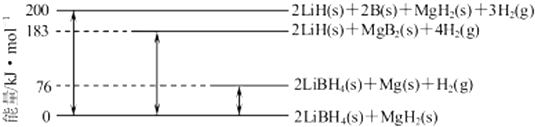
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.100molL﹣1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写) .
(2)上述B步骤操作的目的是 .
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果(填“偏高“、“偏低”或“不变”).
(4)判断到达滴定终点的实验现象是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】呋喃酚是生产农药克百威的主要中间体.其合成路线如下: 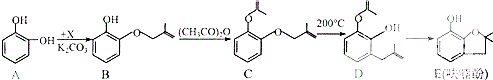
(1)A物质核磁共振氢谱中各组吸收峰的峰面积之比为 , B→C的反应类型是 , E中含氧官能团的名称是 , 1molD最多可以消耗molNaOH.
(2)已知X的分子式为C4H7Cl,写出A→B的化学方程式: .
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y发生消去反应所得产物的名称(系统命名)是 .
(4)下列有关化合物C、D的说法正确的是 . ①可用氯化铁溶液鉴别C和D
②C和D含有的官能团完全相同
③C和D互为同分异构体
④C和D均能使溴水褪色
(5)E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式 . ①属于芳香族化合物
②苯环上的一氯代物只有一种
③含有酯基
④能发生银镜反应.
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中 ![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mLpH=11的NaOH溶液,混合液的pH=7
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化铜矿石含有CuO和难溶于水的Cu2(OH) 2CO3 , 还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某厂生产硫酸铜和硫酸亚铁流程如下: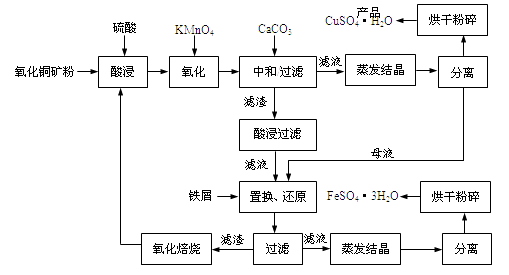
(1)氧化铜矿石粉碎的目的是,KMnO4的作用是将Fe2+氧化成Fe3+。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是,使Fe3+ 水解成沉淀而除去。
(4)流程中多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、。
(5)加入铁屑的作用是使母液中Fe3+转化为Fe2+、。
(6)下表为硫酸铜晶体“烘干粉碎”的试验结果。
表中m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水个数。据此可确定由CuSO4·5H2O脱水得流程所示产品的适宜工艺条件为(指出条件的温度和时间)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶C中溶液蓝色刚好消失时,立即关闭活塞A。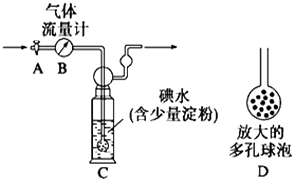
(1)C中导管末端连接一个多孔球泡D,其作用是 , 可以提高实验的准确度。
(2)C中发生反应为SO2 + I2 +2H2O = H2SO4+ 2HI , I2 是(氧化剂、还原剂)。
(3)某同学根据反应:SO2 +2FeCl3+2H2O = H2SO4+2FeCl2+2HCl,设计了一个实验,比较SO2与Fe2+ 还原性的强弱:取少量C中溶液于试管中,滴加2mL氯化铁溶液,摇匀,滴入几滴KSCN溶液,溶液不变红色 ,(试剂任选,请完善步骤、现象和结论)。
(4)① 当流量计B中刚好通过2L尾气时,C中溶液蓝色刚好消失,立即关闭活塞A,容器C中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为g/L。 (相对原子质量: Ba-137 S-32 O-16)
② 若洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质按酸、碱、盐、有机物、混合物顺序排列的是
A. 硝酸、苛性钠、明矾、四氯化碳、氯水
B. 碳酸氢钠、消石灰、食盐、酒精、合金
C. 醋酸、纯碱、碳酸钙、苯、石油||
D. 硫酸、生石灰、高锰酸钾、甲烷、石油
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2 , 实验装置如图所示:回答下列问题: 
(1)仪器a的名称为;装置C的作用是 .
(2)该实验必须使NaClO3稍微过量,目的是 .
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 .
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 则另一种为 .
(5)B中反应的离子方程式为 .
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入(填序号,下同)酸化,再加入检验. ①稀HNO3②稀H2SO4③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9g NaClO23H2O(相对质量:144.5),至少需g NaClO3(相对质量:106.5).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com