
科目: 来源: 题型:
【题目】850℃时反应A(g)+B(g) ![]() C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(molL﹣1)变化
C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(molL﹣1)变化
时间/min | A | B | C | D |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | 0.100 | 0.200 | 0.100 | 0.100 |
4 | 0.100 | 0.200 | 0.100 | 0.100 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(1)计算t℃该化学反应的平衡常数:
(2)t℃850℃(填大于、小于或等于).判断依据是
(3)反应在4min~5min之间,平衡(填“向左”、“向右”或“不”)移动,可能的原因是
a.增加A的浓度 b.增加D的浓度 c.加压 d.使用催化剂
(4)某温度下反应C(g)+D(g)A(g)+B(g)的平衡浓度符合c(C)c(D)=2c(A)c(B),则此时的温度850℃(填大于、小于或等于).
查看答案和解析>>
科目: 来源: 题型:
【题目】控制变量是科学研究的重要方法。相同质量的铁与足量稀硫酸分别在下列条件下发生反应,其中化学反应速率最大的是
选项 | 硫酸浓度 | 反应温度 | 铁的状态 |
A | 2.0 mol/L | 20℃ | 块状 |
B. | 0.5 mol/L | 20℃ | 粉末状 |
C. | 1.0 mol/L | 40℃ | 块状 |
D. | 2.0 mol/L | 40℃ | 粉末状 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】水煤气是一种低热值煤气,主要成分为H2和CO,主要作为工业上合成氨和液体燃料的原料.
(1)反应CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41KJ/mol的v﹣t图象如图1所示,若其他条件不变,只是在反应前缩小体积使压强增大,则其v﹣t图象如图2所示. 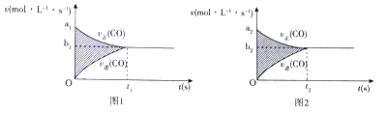
下列说法正确的是
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图2阴影部分面积更大
A.①④⑤⑦
B.①③⑥⑦
C.②④⑤⑧
D.②④⑤⑦
(2)在一定温度下将C单质和CO2(g)各0.10mol充入体积为1L的恒容密闭容器中发生反应C(s)+CO2(g)2CO(g)△H=+172KJ/mol.
①下列示意图正确且能说明反应在t1时刻已经达到化学平衡状态的是(填序号).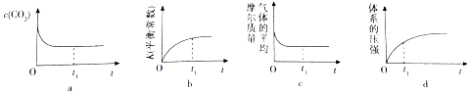
②达到平衡时,容器内的压强为起始时的1.5倍,则此时反应的化学平衡常数K=;若此时再分别加入0.05mol的CO2和0.1mol的CO,则此时平衡将(填“左移”、“右移”或“不移动”.)若将该反应的起始条件改为恒温恒压,则达到平衡时,CO2的转化率将(填“增大”“减小”或“不变”).
(3)工业上用焦炭和水蒸气制备水煤气的热化学方程式为
(4)在一定条件下以CO和H2为原料可以合成乙醇,反应方程式为:2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)△H=aKJ/mol.
请从反应能否自发进行的角度解释a一定小于0的原因: , 若只改变反应的一个条件,能使平衡体系中n ![]() 增大的措施有(答出两点即可)
增大的措施有(答出两点即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是一种重要的化工原料。下列物质中,不能通过乙烯的加成反应一步制得的是
A. CH2BrCH2BrB. CH3CHOC. CH3CH2OHD. CH3CH2Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】(多选)恒温下,容积均为2L的密闭容器M,N中,分别有以下列两种起始投料建立的可逆反应3A(g)+2B(g)2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3mol A、2mol B;2min达平衡,生成D 1.2mol,测得从反应开始到平衡C的速率为0.3mol(Lmin)﹣1 . N:2mol C,y mol D;达平衡时c(A)=0.6molL﹣1 . 下列推断的结论中不正确的是( )
A.x=2
B.平衡时M中c(A)<0.6 mol/L
C.y>0.8
D.M,N达到平衡时容器中各物质浓度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y是元素周期表前20号元素,且X的原子序数比Y大4.
(1)若X的氧化物、氯化物都是实验室常用的干燥剂.
(i)含有X元素的一种盐溶液和Y的一种气态氧化物均是工农业生产中常见的漂白剂,则等物质的量的二者在水溶液中发生反应的化学方程式为
(ii)酸性土壤改变会施用X的一种气态氧化物,但不能与氮肥同时施用,原因为
(2)若X是金属性最强的短周期元素
(i)单质X着火,可用来灭火.
(ii)Y与氢元素能形成一种摩尔质量为43g/mol的共价化合物,已知该物质受到撞击即可放出大量的气体,写出对应的化学方程式:
(3)若X的离子半径是第三周期离子半径最小的
Y与钙元素形成的化合物的电子式为;Y2与NaOH溶液反应的产物之一是OY2 , 该反应的离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( ) 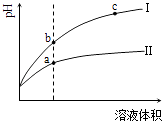
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com