
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.用碳酸钡或硫酸钡做钡餐
B.药物能治疗疾病,故多吃点没关系
C.鸦片、吗啡、海洛因等毒品危害极大,没有任何益处
D.为了预防、治疗疾病,家庭应自备一些常用的非处方药,以供急用
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如下元素周期表,以下说法正确的是( )
A.X、Y、Z元素分别为N、P、O
B.白格中都是主族元素,灰格中都是副族元素
C.原子半径:Z>X>Y
D.X、Y、Z的气态氢化物中最稳定的是Y的氢化物
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下的HCl气体4.48L溶于水形成100ml溶液,然后与足量的铁屑充分反应.计算:
(1)所得盐酸的物质的量浓度;
(2)生成H2的体积;
(3)将生成的FeCl2配成400ml溶液,此溶液中FeCl2的物质的量浓度是多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2.若忽略两溶液混合时的体积变化,则加入稀硫酸的体积与原BaCl2溶液的体积比是( )
A.10:1
B.1:10
C.9:1
D.1:9
查看答案和解析>>
科目: 来源: 题型:
【题目】已知pH表示溶液中c(H+)的负对数,同样也可以定义pOH表示溶液中c(OH﹣)的负对数,即pOH=﹣lg(OH﹣),温度T时水的离子积常数用KW表示,则此温度下不能判定溶液呈中性的依据是( )
A.![]() =1
=1
B.pOH= ![]()
C.c(H+)=10﹣pOH
D.pH+pOH= ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NaHSO4在水中电离方程式为:NaHSO4=Na++H++SO42﹣ . 某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,对于该溶液,下列叙述中不正确的是( )
A.该温度高于25℃
B.c(H+)=c(OH﹣)+c(SO42﹣)
C.水电离出来的c(H+)=1×10﹣10molL﹣1
D.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下.
提出猜想:
问题1:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题2:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
Ⅰ.解决问题1取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在.根据以上实验现象回答问题.
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式: ,
(2)从实验Ⅰ可得出的结论是
(3)Ⅱ.解决问题2
设计如下装置(夹持装置未画出):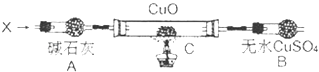
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01mol X,测得B装置增重0.36g,并收集到0.28g单质气体Y.
X气体的摩尔质量是 .
(4)C中发生反应的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,操作为:
(1)①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000molL﹣1KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色.将锥形瓶摇动一时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了.请解释原因: .当 ,证明达到滴定终点.
(2)③计算:再重复上述操作2次,记录实验数据如下.
序号 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.00 | 22.10 |
则消耗KMnO4溶液的平均体积为 mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 .
(3)④误差分析:下列操作会导致测定结果偏高的是 .
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com