
科目: 来源: 题型:
【题目】某同学按下列步骤配制100mL0.200molL﹣1Na2CO3溶液,请回答有关问题.
实验步骤 | 有关问题 |
(1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为 . |
(2)称量Na2CO3固体 | 称量过程中应用到的主要仪器是 . |
(3)将Na2CO3加入100mL烧杯中,加入适量蒸馏水 | 为了加快溶解速率,常采取的措施是 . |
(4)将烧杯中的溶液转移至仪器A(已检查不漏水)中 | ①在转移Na2CO3溶液前应将溶液 ; |
(5)向仪器A中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 . |
(6)摇匀、装瓶,操作B,最后清洁、整理 | 操作B是 . |
讨论按上述步骤配制的Na2CO3溶液的浓度 (选填“是”或“不是”)0.200molL﹣1 . 理由是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A. 1 molNaCl约含有6.02×1023个NaCl分子
B. 1 mol Ne中含有约6.02×1024个电子
C. 1 mol水中含2 mol氢和1 mol氧
D. 标准状况下,11.2L CCl4所含分子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示: 
(1)装置C的作用是 .
(2)若要从FeSO4溶液获得FeSO47H2O晶体,必须进行的实验操作步骤:、、过滤、洗涤、自然干燥.
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式;
②请写出检验A烧杯中有Fe2+生成的操作方法;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣ . 该做法(填“合理”或“不合理”),理由是 .
(4)能表明I﹣的还原性弱于SO2的现象是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某盐的混合物中含有0.2mol Na+、0.4mol Mg2+、0.4mol Cl-,则SO42-为
A. 0.1mol B. 0.3mol C. 0.5mol D. 0.15mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列反应中, HCl 作氧化剂的是( )
A. NaOH+HCl=NaCl+H2O
B. Zn+2HCl=ZnCl2+H2↑
C. MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D. CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3.试回答下列问题:

(1)在A试管内发生反应的化学方程式是____________________________________.
(2)B装置的作用是_______________________________________________________.
(3)在双球干燥管内发生反应的化学方程式为___________________________________.
(4)双球干燥管内观察到的实验现象是_________________________________________.上述实验现象说明________________________________________________________.
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是______________________________________________________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。

(1)写出代表各线段发生的反应的离子方程式:
OD段________________________________________________,
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为________。
(3)图中C点表示当加入______mol NaOH时,Al3+已经转化为_____,Mg2+已经转化为______。
(4)图中线段OA∶AB=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的一些问题:
(1)上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(2)保存过氧化氢试剂瓶上的最适合贴上的一个标签是 (填字母代号)。

(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①写出该反应的离子方程式并配平_______________________________。
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数目为 。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图1所示.已知 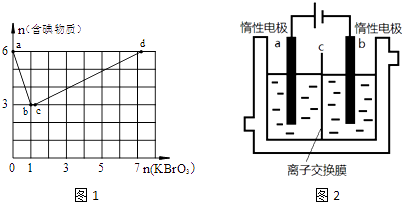
①BrO3﹣+6I一+6H+=3I2+Br﹣+3H2O;
②2BrO3﹣+I2=2IO3﹣+Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 , 还原产物是 .
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 .
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 .
(4)含6mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 .
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图2所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.阳极的电极反应式为;阴极观察到的现象是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com