
科目: 来源: 题型:
【题目】下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀. 
请回答下列问题:
(1)B中所含元素位于周期表中第周期,族.
(2)A在B中燃烧的现象是 .
(3)D+E→B的反应中,被氧化与被还原的物质的物质的量比是 .
(4)G+J→M的离子方程式是 .
(5)Y受热分解的化学方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上.
(1)下列物质不属于硅酸盐的是
A.陶瓷
B.玻璃
C.水泥
D.生石灰
(2)SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为 , 工艺师常用(填物质名称)来雕刻玻璃.
(3)用Na2SiO3溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作 , Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是 .
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氯化铝坩埚 D.铁坩埚
(4)工业上常用2C+SiO2 ![]() Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是(填化学式,下同),氧化剂是 .
Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是(填化学式,下同),氧化剂是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 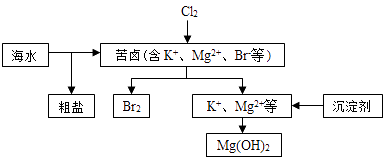
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。

资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)A处分液漏斗上方的胶皮管的作用是______________________________________。
(2)实验中B装置中选用的试剂为________,该装置的作用是___________________。
(3)写出D中物质制备的化学方程式_______________________________________;写出四氯化钛在空气中发烟的化学方程式_________________________________。
(4)E处球形冷凝管的作用是____________________________________________,该装置冷却水应从________(填“c”或“d”)口通入。
(5)仪器F中盛装的物质是________。
(6)该实验设计略有缺陷,请指出其不足之处__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,又属于吸热反应的是
A. 锌片与稀硫酸的反应B. Ba(OH)2·8H2O与NH4C1的反应
C. 甲烷在空气中的燃烧反应D. 高温条件下炭与CO2的反应
查看答案和解析>>
科目: 来源: 题型:
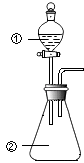
【题目】用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究. 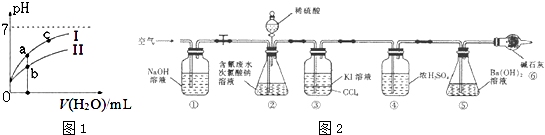
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 |
(1)NaCN溶液呈碱性的原因是(用离子方程式表示)
(2)如图1表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度
的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:
CN﹣+CO2+H2O=HCN+CO32﹣
C.图象中a、c两点处的溶液中 ![]() 相等(HR代表HCOOH或HCN)
相等(HR代表HCOOH或HCN)
D.图象中a点酸的总浓度小于b点酸的总浓度
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为 .
(4)探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用如图2所示装置进行实验.将CN﹣的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4 , 关闭活塞.
已知装置②中发生的主要反应依次为:
CN﹣+ClO﹣═CNO﹣+Cl﹣
2CNO﹣+2H++3C1O﹣═N2↑+2CO2↑+3C1﹣+H2O
处理含CN﹣废水时,如用NaOH溶液调节pH至9时,此时c(CN﹣)c(HCN)(填“>”、“<”或“=”)
(5)①和⑥的作用是 .
(6)反应结束后,缓缓通人空气的目的是 .
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置反应前后的质量(从装置①到⑥中选择,填装置序号).
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2A2(g)+B2(g)2C3(g);△H=﹣Q1 kJ/mol(Q1>0),在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2 , 在500℃时充分反应,达平衡后C3的浓度为w molL﹣1 , 放出热量为Q2 kJ.
(1)达到平衡时,A2的转化率为 .
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3 , 500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度(填>、=、<)w molL﹣1 , Q1、Q2、Q3 之间满足何种关系:Q3=
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是; 
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容容器,起始时加入4molA2和2molB2 , 500℃时充分反应达平衡后,放出热量Q4kJ,则Q2Q4 (填“>”、“<”或“=”).
(6)下列措施可以同时提高反应速率和B2的转化率是(填选项序号). a.选择适当的催化剂 b.增大压强 c.及时分离生成的C3 d.升高温度.
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是中学化学实验室的常见药品,回答下列实验问题。
Ⅰ.配制一定物质的量浓度的硫酸溶液:
(1)某次实验大约需要1mol/L硫酸溶液435ml。同学们发现实验室内没有450ml的容量瓶,某同学提议用1个200ml容量瓶和1个250ml容量瓶来配制,你认为该提议_________(填“合理”、“不合理”)。
(2)实验中要配制0.5mol/L H2SO4溶液250ml。则需量取密度为1.84g/ml、98%的浓硫酸________ml。

Ⅱ.蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,会对环境造成污染。某实验小组利用如下装置对该实验进行改进。回答下列问题:
注:硬质玻璃管中①、②、③处分别为滴有Na2S溶液的滤纸、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
(1)图中盛装浓硫酸的仪器名称为________________。
(2)实验开始后先关闭活塞K,硬质玻璃管中①号试纸变黄,②号和③号滤纸均褪色,a处气球变大。硬质玻璃管中实验现象说明炭化实验产生的刺激性气味气体是SO2,①、②、③处发生的变化分别说明SO2具有_____________、_____________和_____________(填SO2表现出的性质)。
(3)打开活塞K,a处气球变小,b处气球变大。使三颈烧瓶内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊。为证明有CO2生成,可以在④号位置的滤纸滴加______________溶液,该试剂的作用是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com