
科目: 来源: 题型:
【题目】标准状况下,某同学向100mL H2S饱和溶液中通入SO2 , 所得溶液pH变化如图所示.下列分析中正确的是( ) 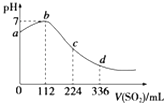
A.b点对应的溶液导电性最强
B.亚硫酸是比氢硫酸更弱的酸
C.ab段反应是SO2+2H2S═3S↓+2H2O
D.原H2S溶液的物质的量浓度为0.05molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是( ) 
A.图1表示常温下向体积为10 mL 0.1 molL﹣1NaOH溶液中逐滴加入0.1 molL﹣1 CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH﹣)
B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C.图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJmol﹣1
D.由图4得出若除去CuSO4溶液中的Fe3+ , 可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( ) 
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.12.5mL 16molL﹣1浓硫酸与足量铜反应,转移电子数为0.2NA
C.7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA
D.0.5mol雄黄(As4S4 , 结构如图)含有NA个S﹣S键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列相关离子方程式书写正确的是( )
A.NaClO溶液与FeCl2溶液混合:6Fe2++3ClO﹣+3H2O═2Fe(OH)3↓+3Cl﹣+4Fe3+
B.用食醋检验牙膏中的碳酸钙:CaCO3+2H+═Ca2++CO2↑+H2O
C.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O
D.电解MgCl2水溶液的离子方程式:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A.![]() Cl2与
Cl2与 ![]() Cl2氧化能力相近,二者互为同位素
Cl2氧化能力相近,二者互为同位素
B.![]() Se与
Se与 ![]() Se所含质子数相同,中子数不同
Se所含质子数相同,中子数不同
C.同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱
D.同周期主族元素形成的简单离子半径随核电荷数的增大而减小
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图1所示。请填写下列空白:
(1)在该溶液中含有的离子是_____________,物质的量浓度之比为_______________。
(2)所加的淡黄色固体是________________(化学式)。

(二)黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1 g该黄铁矿石的样品放入如图2装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:![]()
【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(3)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)________________________________________。
(4)该黄铁矿石中硫元素的质量分数为______________(列出表达式即可)。
【实验二】:测定铁元素的含量

(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了三次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫. 
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是(填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠g (保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰﹣石膏法和碱法是常用的烟气脱硫法.
石灰﹣石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO42H2O.其流程如图1,碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图2:
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰﹣石膏法和碱法吸收二氧化硫的化学原理相同之处是 . 和碱法相比,石灰﹣石膏法的优点是 , 缺点是 .
(4)在石灰﹣石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】学习小组拟通过实验,探究Mg(NO3)2受热分解的产物.
小组猜想:ⅰ.固体产物可能有Mg(NO2)2、MgO、Mg3N2中的一种或几种
ⅱ.气体产物可能有NO2、N2、O2中的一种或几种
查得相关资料:a.Mg(NO2)2、Mg(NO3)2易溶于水,MgO难溶于水.
b.2NO2+2NaOH=NaNO3+NaNO2+H2O
c.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
针对以上猜想,设计了如图所示实验(图中加热、夹持仪器等装置均省略):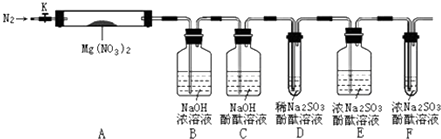
进行实验
Ⅰ.检验上述装置气密性.
Ⅱ.称取3.7gMg(NO3)2固体,置入硬质玻璃管A中,打开K,通入一段时间N2 , 并进行相关物质质量称量
Ⅲ.关闭K,用酒精灯持续给装置A加热,过程中各装置内溶液均未倒吸入其它装置.
Ⅳ.待Mg(NO3)2完全分解,装置冷却至室温,打开K,再缓慢通入一会N2后并再称量.称得A中剩余固体质量为1.0g,B、C、D、E、F中溶液质量分别增加了2.3g、0.0g、0.1g、0.3g、0.05g.
Ⅴ.取少量剩余固体于试管中,加入适量水,未出现明显现象.
(1)回答问题
①小组预测一定有O2生成,理由是 .
②N2的电子式是 , 步骤Ⅱ中,通入一段时间N2的目的是 .
③步骤Ⅲ中,装置A内若出现了红棕色气体,其化学式是 .
④装置C中若红色始终未褪,其设计的目的是 .
⑤实验中发现Mg(NO3)2分解时有O2生成,其实验现象是 , 用化学用语解释,产生上述现象的原因是 .
⑥实验中Mg(NO3)2分解没有N2生成的理由是 .
⑦Mg(NO3)2分解的化学方程式是 .
⑧装置F中溶液质量增加的原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:T℃、P kpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g)C(g),平衡时C 的体积分数为40%.
(1)欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 , C的体积分数为 .
(2)另取一个容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40%,则该密闭容器体积为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com