
科目: 来源: 题型:
【题目】甲苯氧化法制备苯甲酸的反应原理如下: 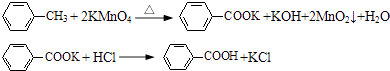
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯.
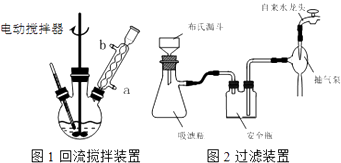
(1)实验室中实现操作Ⅰ所需的玻璃仪器有、烧杯;操作Ⅱ的名称为 .
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 .
(3)在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是;如图2所示抽滤完毕,应先断开橡皮管.
(4)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10﹣3 mol.产品中苯甲酸质量分数为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.08mol气体;
第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
(已知, ![]() +OH-
+OH-![]() H2O+NH3↑)
H2O+NH3↑)
根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?____________(答是或否)。
(2)由第二份进行的实验得知混合物中应含有____________(填离子符号),其物质的量浓度为____________。
(3)由第三份进行的实验可知12.54g沉淀的成分为____________。
(4)综合上述实验,你认为以下结论正确的是(______)
A.该混合液中一定含有K+、![]() 、
、![]() 、
、![]() ,可能含Cl-,且n(K+)≥0.04mol
,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含K+、Cl-
,可能含K+、Cl-
C.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
D.该混合液中一定含有![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:
(1)化学键断裂需要(填“释放”或“吸收”)能量;
(2)图中表示了吸收和释放的能量,其中释放的能量共kJ;
(3)该反应的反应物的总能量(填“大于”、“等于”或“小于”)反应产物的能量,所以该反应是(填“放热”或“吸热”)反应;
(4)用图示数据计算其反应热,写出该反应的热化学方程式 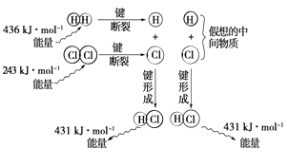
查看答案和解析>>
科目: 来源: 题型:
【题目】判断下列有关化学基本概念的依据正确的是
A. 溶液与胶体:本质区别是能否发生丁达尔效应
B. 纯净物与混合物:是否仅含有一种元素
C. 物理变化与化学变化:是否有新物质生成
D. 电解质与非电解质:物质本身的导电性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各物质所含原子个数按由大到小的顺序排列的是
①0.5molNH3 ②1molHe ③0.5molH2O ④0.2molH3PO4
A. ①④③② B. ④③②① C. ②③④① D. ①④②③
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为 ![]() ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)元素A、B、C、D分别是:A , B , C , D .
(2)D元素在周期表中属第周期族.
(3)用电子式表示A的气态氢化物的形成过程: .
(4)A和B的单质充分反应生成化合物的电子式是 .
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明; .
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为 ![]() ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)元素A、B、C、D分别是:A , B , C , D .
(2)D元素在周期表中属第周期族.
(3)用电子式表示A的气态氢化物的形成过程: .
(4)A和B的单质充分反应生成化合物的电子式是 .
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明; .
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)(1)用胆矾(CuSO4·5H2O)配制0.200mol/L CuSO4溶液240mL,所需要的玻璃仪器为:烧杯、量筒、________________________(要填全),应称取胆矾的质量为____________。
(2)下列操作使所配CuSO4溶液浓度偏低的是____________。
A.观察刻度线时仰视
B.观察刻度线时俯视
C.定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水至标线
D.配制溶液前,容量瓶中有少量蒸馏水
(二)(1)用单线桥标出该反应的电子转移方向和数目,并回答相关问题:
KClO4+8HCl(浓)=KCl+4Cl2↑+4H2O____________,氧化剂与还原剂的物质的量之比为____________。
(2)配平化学方程式(将化学计量数填于空白处)
_____KMnO4+___FeSO4+___H2SO4=___K2SO4+__MnSO4+__Fe2(SO4)3+__H2O
氧化产物与还原产物的物质的量比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com