
科目: 来源: 题型:
【题目】在2A(g)+B(g)3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.VA=1.0 mol/(LS)
B.VB=0.6 mol/( LS)
C.VC=1.6 mol/(LS)
D.VD=2.0 mol/(LS)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池,该固体氧化物电解质在700﹣900℃温度时,O2﹣可在该固体氧化物电解质中自由移动,电池反应生成均为无毒无害的物质,下列说法正确的是( ) 
A.电池内的由O2﹣电极乙移向电极甲
B.电池的总反应为:N2H4+2O2═2NO+2H2O
C.当甲电极上有1molN2H4消耗时,乙电极上有1molO2被氧化
D.电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目: 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )
2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列说法正确的是( )
A.100mL12LmolL﹣1浓盐酸与足量MnO2共热,转移的电子数为0.6NA
B.1molL﹣1的NaClO溶液中含有ClO﹣的数目为小于NA
C.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA
D.O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义.
(1)部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01molL﹣1)溶液的PH和原子序数的关系如图所示. 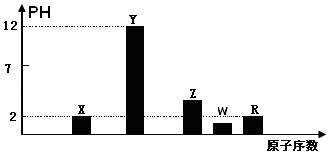
(i)元素R在周期表中的位置是
(ii)元素Y和W形成的Y2W2型化合物中含有化学键的类型为
(iii)请写出X的最高价氧化物对应的水化物与其气态氢化物的离子反应方程式
(2)短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(i)下列能说明碳、硫两种元素非金属性相对强弱的是(填序号)
A.S与H2发生化合反应比C与H2化合更容易
B.酸性:H2SO3>H2CO3
C.稳定性:CH4<H2S
(ii)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为:
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如图:
已知A是一种正盐,则反应I的化学反应方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液中可能有下列阴离子中的一种或几种:SO![]() 、SO
、SO![]() 、S2-、CO
、S2-、CO![]() 、Cl-。
、Cl-。
①当溶液中有大量H+存在时,则不可能有存在。
②当溶液中有大量Ba2+存在时,则不可能有存在。
③当溶液中有和等阳离子存在时,上述所有阴离子都不可能存在。
④当向溶液中通入足量的Cl2时,离子在溶液中不可能存在。
查看答案和解析>>
科目: 来源: 题型:
【题目】海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI===2KCl+I2。请回答下列问题:
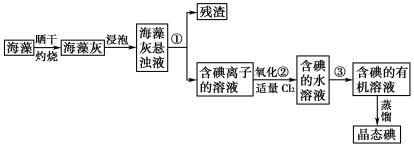
(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1 mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为紫红色溶液)。

(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①________________________________;
②________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.O2和O3互为同位素
B.金刚石、石墨、富勒烯互为同素异形体
C.有机物CH3-CH2-NO2和H2N-CH2-COOH互为同分异构体
D.C4H10的一氯代物有四种,其熔沸点各不相同
查看答案和解析>>
科目: 来源: 题型:
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计如下实验方案:

(1)操作①为________;
(2)操作②~④加入的试剂可以为________;
(3)如何判断SO已除尽,简述实验操作____________________
__________________________________________________________;
(4)实验过程中产生的多次沉淀________(填“需要”或“不需要”)多次过滤,理由是
__________________________________________________________。
(5)该同学设计的实验方案________(填“合理”或“不合理”),理由是__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填写下列问题:
(1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2OH3O++OH﹣ , 则液态NH3电离的方程式是
(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=10,则该温度下水的KW= , 在此温度下,将pH=b的NaOH溶液Vb L与pH=a的H2SO4溶液Va L混合,若所得混合液为中性,且a+b=13,则Va:Vb=
(3)25℃时,0.1mol/L的HA溶液中 ![]() =1010 . 请回答下列问题:
=1010 . 请回答下列问题:
①HA是(填“强电解质”或“弱电解质”).
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是(填字母)
A.c(HA) B. ![]() C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
(4)在常温下,中和相同体积,相同pH的Ba(OH)2、NH3H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3 , 则三种关系为(用“V1、V2、V3”和“>、<、=”表示).
(5)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是 . (填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是 , 反应所用时间长短关系是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com