
科目: 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( ) 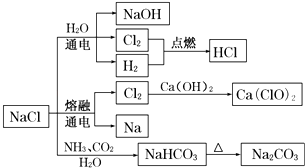
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.NaHCO3 受热分解的方程式为:2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.电解饱和氯化钠溶液的方程式为:2NaCl ![]() 2Na+Cl2↑
2Na+Cl2↑
D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)饱和碳酸钠溶液的主要作用是、、 .
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是 .
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 .
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是
①钠的化合物 ②能与硝酸反应的物质 ③可溶于水的物质
④钠盐 ⑤钠的含氧化合物
A. ①③④⑤ B. ①②⑤ C. ②④⑤ D. ①③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.氢氧化钠的电子式: ![]()
B.质子数为53、中子数为78的碘原子: ![]()
C.水分子比例模型: ![]()
D.对硝基甲苯的结构简式: ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程中,涉及化学变化的是
A. 四氣化碳萃取碘水中的碘 B. 生石灰被用作干燥剂后失效
C. 过滤除去粗盐中的不溶性杂质 D. 蒸馏法将海水淡化为饮用水
查看答案和解析>>
科目: 来源: 题型:
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性.
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 |
(1)对实验Ⅰ进行研究②④ ①实验Ⅰ中生成红色物质的离子方程式为:
②经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:
③请写出60s后反应进一步加快可能的原因(写出两条)
(2)对实验Ⅱ进行研究 实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42﹣对Al与Cu2+的置换反应存在一定的抑制作用.
假设二:
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
实验Ⅵ的设计目的是:
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:
(4)请设计实验证明Cl﹣对Al与H+的反应同样起到相似的作用:
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为8CuFeS2+21O2 ![]() 8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号).
8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号).
(2)冶炼铜的主要流程如图1: 
①气体A中的大气污染物可选用下列试剂中的吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液
②用稀HNO3浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为+3的结论.请指出该结论是否合理并说明理由
(3)冶炼出的铜可以发生下列反应(图2) ①写出Cu溶于稀H2SO4和H2O2混合液的离子方程式: .
②写出Cl2将Z氧化为K2EO4的化学方程式: .
③对于0.1molL﹣1 CuSO4溶液,正确的是 .
A、常温下,pH>7
B、c(Cu2+)>c(SO42﹣)>c(H+)>c(OH﹣)
C、c(H+)+2c(Cu2+)=2c(SO42﹣)+c(OH﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】“一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础.
(1)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式 已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=﹣25kJmol﹣1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=﹣47kJmol﹣1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJmol﹣1③
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体. ①写出该反应的离子方程式: .
②在纳米钴的催化作用下,肼可以发生分解反应3N2H4(g) ![]() N2(g)+4NH3(g)
N2(g)+4NH3(g)
保持温度不变,向容积固定的容器中充入一定量的肼,下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.单位时间内生成amol N2的同时,生成4molNH3
c.N2H4和NH3的物质的量之比保持不变的状态
d.混合气体的平均摩尔质量保持不变的状态
若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图1所示,其中曲线b表示的是(物质的化学式)的体积分数随温度的变化情况,为抑制肼的分解,可采取的合理措施有(任写一种).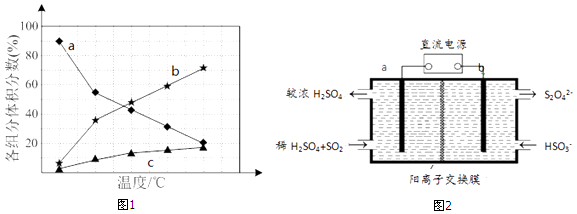
(3)大气污染气的主要成分是SO2和NO2 . 利用图2所示装置(电极均为惰性电极)可以吸收SO2 , 还可以用阴极排出的溶液吸收NO2 . ①a极为(填“阴”“阳”) b极的电极反应式为 .
②简述该装置能吸收SO2的原理: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com