
科目: 来源: 题型:阅读理解

查看答案和解析>>
科目: 来源: 题型:
| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3. | (1) 在白色浑浊物中加入过量盐酸,会变澄清 在白色浑浊物中加入过量盐酸,会变澄清 |
假设2 |
(2)白色浑浊物是BaSO4,主要 原因是 Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 . |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊 (3)通入纯净的CO2的目的 防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 |
查看答案和解析>>
科目: 来源: 题型:
 以下是某实验小组用CO2和NaOH溶液做喷泉实验的装置和测得的一组数据
以下是某实验小组用CO2和NaOH溶液做喷泉实验的装置和测得的一组数据| NaOH浓度(mol/L) | 0 | 0.4 | 0.5 | 0.8 | 1.0 | 1.4 | 1.6 | 1.8 |
| 现象 | 不能 形成 |
一段 液柱 |
形成喷泉 | 形成喷泉 | 形成喷泉 | 形成喷泉 | 形成喷泉 | 形成喷泉 |
| 时间 | 6min | 1min | 35s | 10s | 6s | 6s | ||
| 烧瓶中水的体积(mL) | 7 | 41 | 71 | 125 | 240 | 240 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
| 1 |
| V |
| 1 |
| V |
查看答案和解析>>
科目: 来源: 题型:阅读理解
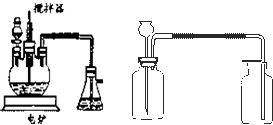 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
| ||
| ||
| ||
| ||


查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:阅读理解
 Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑ Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 正极 | NaOH | Al-3e-=Al3+ | 2H2O+2e-=2OH-+H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Cu-2e--=Cu2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
| D | 负极 | 稀硝酸 | Cu-2e-=Cu2+ | 2NO3-+8H+=2NO↑+4H2O+6e- |
查看答案和解析>>
科目: 来源: 题型:
 某同学设计和进行了如图试验:
某同学设计和进行了如图试验:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com